
【題目】Ⅰ.下列說法正確的是__________。
A.元素的電負性越大,其單質越穩定
B.分子晶體中可能不存在共價鍵
C.晶格能越大,形成的離子晶體越穩定
D.金屬晶體和離子晶體均具有延展性
Ⅱ.鋼鐵中含有C、N、Mn等元素,實驗中常用過硫酸鹽氧化法測定鋼鐵中錳的含量,反應原理為2Mn2++5S2O82-+8H2O ![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)Mn原子的價層電子的軌道表達式(電子排布圖)為____________________。
(2)已知H2S2O8的結構簡式如圖所示。

①H2S2O8中S的軌道雜化方式為______________,H、O、S三種元素中,電負性最大的元素是___________(填元素符號)。
②S基態原子中電子的運動狀態有_________種。
③上述反應中S2O82-斷裂的共價鍵類型為___________(填“σ鍵”或“π鍵”) ,每生成1mol MnO4-,斷裂的共價鍵數目為___________NA。

(3)C和N能形成多種結構的晶體。一種新型的超硬材料類似于金剛石的結構,但硬度比金剛石大,其晶胞如圖所示(圖示原子都包含在晶胞內),其化學式為______________。已知晶胞參數a=0.64nm,b=0.55nm,c=0.24nm,則該晶體的密度為_______________(列出式子即可,但式子中不包含字母)g/cm3。
【答案】 BC ![]() sp3 O 16 σ鍵 2.5 C3N4
sp3 O 16 σ鍵 2.5 C3N4 ![]()
【解析】試題分析:Ⅰ.A.單質穩定性與分子結構有關;B.稀有氣體構成的分子晶體中不存在共價鍵;C.晶格能越大,離子鍵鍵能越大;D.離子晶體不均具有延展性。
Ⅱ.(1)Mn是25號元素,價電子的電子排布式是![]() ,根據洪特規則和泡利不相容原理,寫Mn價層電子的軌道表達式。
,根據洪特規則和泡利不相容原理,寫Mn價層電子的軌道表達式。
(2)根據價層電子對=σ 鍵電子對+中心原子上的孤電子對,結合S2O8 2-的結構判斷S原子雜化類型;非金屬性越強電負性越大。
原子核外有一個電子就有1種運動狀態。
反應中S2O82-斷裂的共價鍵是O-O單鍵,單鍵都是σ鍵,根據離子方程式每生成2mol MnO4-,消耗5mol S2O82-;
(3)圖示原子都包含在晶胞內,根據圖示,每個晶胞含有6個C原子、8個N原子;每個晶胞的質量是![]() ;每個晶胞的體積是
;每個晶胞的體積是![]() ,根據
,根據![]() 計算密度;
計算密度;
解析:Ⅰ.A.單質穩定性與分子結構有關,如F的電負性大于N,N2比F2穩定,故A錯誤;B.稀有氣體構成的分子晶體中不存在共價鍵,故B正確;C.晶格能越大,離子鍵鍵能越大,晶體越穩定,故C正確;D.離子晶體不均具有延展性,故D錯誤。
Ⅱ.(1)Mn是25號元素,價電子的電子排布式是![]() ,根據洪特規則和泡利不相容原理, Mn價層電子的軌道表達式是
,根據洪特規則和泡利不相容原理, Mn價層電子的軌道表達式是![]() 。
。
(2)①硫原子價層電子對數=σ 鍵電子對+中心原子上的孤電子對=4+12(6-4×1-2)=4,所以S原子采取sp3雜化;非金屬性越強電負性越大,H、O、S三種元素中,電負性最大的元素是O。
②有一個電子就有1種運動狀態,S原子核外有16個電子,所以S基態原子中電子的運動狀態有16種。
③反應中S2O82-斷裂的共價鍵是O-O單鍵,單鍵都是σ鍵,S2O82-斷裂的共價鍵類型為σ鍵;根據離子方程式每生成2mol MnO4-,消耗5mol S2O82-,每生成1mol MnO4-,斷裂的S2O82-中共價鍵數目為2.5 NA;
(3)圖示原子都包含在晶胞內,所以每個晶胞含有6個C原子、8個N原子,化學式為C3N4;每個晶胞的質量是![]() ;每個晶胞的體積是
;每個晶胞的體積是![]() ,根據
,根據![]() ,密度=
,密度= ![]() ÷
÷![]() =
=![]() g/cm3;
g/cm3;


科目:高中化學 來源: 題型:
【題目】等物質的量的 SO2和SO3下列關系錯誤的是( )
A. 所含硫原子的物質的量之比為1:1
B. 氧原子的物質的量之比為2:3
C. 氧元素的質量比為3:2
D. 硫元素的質量比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A. 蛋白質都是由C、H、N、 O四種元素組成的
B. 蛋自質水解的最終產物為氨基酸
C. 強酸、強堿和重金屬鹽都可使蛋白質變性
D. 構成蛋白質的某些氨基酸人體自身是不能合成的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關實驗現象的敘述中,不正確的是
A. 氫氣在Cl2中燃燒,產生蒼白色火焰,瓶口有白霧生成
B. 鐵絲在Cl2中燃燒,產生棕褐色的煙
C. 鈉在Cl2中燃燒,生成白色的霧
D. 銅絲在Cl2中燃燒,生成棕黃色的煙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組選用下列裝置和藥品制取純凈乙炔并進行有關乙炔性質的探究,試回答下列問題。
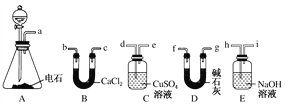
(1)A中制取乙炔的化學方程式為_________________________________。
(2)制乙炔時,旋開分液漏斗的活塞,使水慢慢滴下的原因是_________________。
(3)用電石制得的乙炔中常含有H2S、PH3等雜質,除去雜質應選用________(填序號,下同)裝置,干燥乙炔最好選用________裝置。
(4)為了探究乙炔與HBr發生加成反應后的有關產物,進行以下實驗:
純凈乙炔氣![]() 混合液
混合液![]() 有機混合物Ⅰ
有機混合物Ⅰ![]() 混合液
混合液![]() 有機混合物Ⅱ
有機混合物Ⅱ
①操作b的名稱是________;
②有機混合物Ⅰ可能含有的物質是________(寫結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】肉桂酸甲酯是調制具有草莓、葡萄、櫻桃、香子蘭等香味的食用香精,用于肥皂、洗滌劑、風味劑和糕點的調味,在醫藥工業中作為有機合成的中間體。
(1)肉桂酸甲酯由C、H、O三種元素組成,質譜分析其分子的相對分子質量為162,核磁共振氫譜譜圖顯示有6個峰,其面積之比為1︰2︰2︰1︰1︰3 ,利用紅外光譜儀檢測其中的某些基團,測得紅外光譜如下圖:
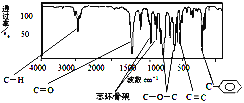
則肉桂酸甲酯的結構簡式是_____________ (不考慮立體異構)。
(2)已知:I.醛與醛能發生反應,原理如下:
![]()
II.已知烴A在標準狀況下的密度為1.25g·L-1。合成肉桂酸甲酯的工業流程如下圖所示:
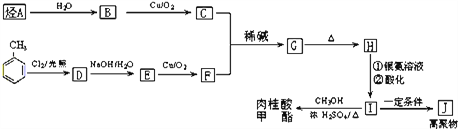
請回答:
①化合物J的結構簡式為_______________;
②化合物G中的官能團有______________;
③G→H為_______________反應(填反應類型);
④寫出反應D→E的化學方程式______________________;
⑤符合下列條件的I的同分異構體共有5種。寫出另兩種同分異構體的結構簡式:_____________
A.能發生水解反應 B.與銀氨溶液作用出現光亮的銀鏡C.能與溴發生加成反應
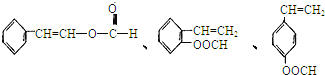
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知甲苯可以進行如下轉化:

回答下列問題:
(1)反應①的反應類型為__________,反應③的反應類型為_____________。
(2)化合物A的結構簡式為____________。化合物D的分子式為_____________。
(3)反應②的化學方程式為_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知:將Cl2通入適量KOH溶液,產物中可能有KC1、KClO、KC1O3,且c(Cl-):c(ClO-)的值與溫度高低有關。當n(KOH)=amol時,若某溫度下,反應后c(Cl-):c(ClO-)=11,則溶液中c(ClO-):c(ClO3-)=_________________
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反應中,7.5molCuSO4可氧化P的物質的量為________mol。生成1molCu3P時,參加反應的P的物質的量為________mol。
(3)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到氣體VL(標準狀況),向反應后的溶液中(存在Cu2+和SO![]() )加入足量NaOH,產生藍色沉淀,過濾,洗滌,灼燒,得到CuO 16.0g,若上述氣體為NO和NO2的混合物,且體積比為1∶1,則V的極小值為________mL。
)加入足量NaOH,產生藍色沉淀,過濾,洗滌,灼燒,得到CuO 16.0g,若上述氣體為NO和NO2的混合物,且體積比為1∶1,則V的極小值為________mL。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1 mol/L 硝酸的溶液100 mL,恰好使混合物全部溶解,且放出336 mL(標準狀況下)的氣體,向所得溶液中加入KSCN溶液,溶液無紅色出現;若取相同質量的Fe、FeO、Fe3O4的混合物,加入1 mol/L的稀硫酸溶液,也恰好使混合物完全溶解(假設還原產物唯一),反應后向所得溶液中加入KSCN溶液,溶液也無紅色出現,則所加入的的稀硫酸的體積是__________mL。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com