
已知在常溫下測得濃度均為0.1 mol·L-1的下列三種溶液的pH:
| 溶質 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
 減小
減小  天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:單選題
不能用于判斷HA是弱電解質(弱酸)的依據是( )
A.濃度相等的HCl與HA兩溶液體積相同時,跟鎂反應生成氫氣HA比HCl多
B.pH相等的HCl與HA兩溶液體積相同時,跟鎂反應生成氫氣HA比HCl多
C.濃度相等的HCl與HA兩溶液,c(H+)HCl約是c(H+)HA的100倍
D.pH相等的HCl與HA兩溶液,c(HA)約是c(HCl)的100倍
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列溶液中有關物質的濃度關系正確的是( )
| A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)> c[(NH4)2SO4]> c(NH4Cl) |
| B.向醋酸鈉溶液中加入適量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.1.0 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D.某二元弱酸的酸式鹽NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知25℃,醋酸、次氯酸、碳酸、亞硫酸的電離平衡常數如表,下列敘述正確的是
| 酸 | 電離平衡常數 |
| 醋酸 | K i=1.75×10-5 |
| 次氯酸 | K i=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亞硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
 SO32— + 2HClO
SO32— + 2HClO HCO3— + HClO
HCO3— + HClO查看答案和解析>>
科目:高中化學 來源: 題型:單選題
用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1鹽酸,如達到滴定終點時不慎多加了1滴NaOH溶液(1滴溶液的體積約為0.05 mL),繼續加水至50 mL,所得溶液的pH是( )
| A.4 | B.7.2 | C.10 | D.11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知同溫度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或電離出S2-的能力而言,FeS>H2S>CuS,則下列離子方程式錯誤的是( )
| A.Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S=CuS↓+2H+ |
| C.Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D.FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
25 ℃時,PbCl2固體在不同濃度鹽酸中的溶解度如圖。在制備PbCl2的實驗中,洗滌PbCl2固體最好選用( )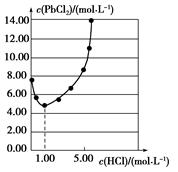
| A.蒸餾水 |
| B.1.00 mol·L-1鹽酸 |
| C.5.00 mol·L-1鹽酸 |
| D.10.00 mol·L-1鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
以甲基橙為指示劑,用0.10 mol·L-1的鹽酸滴定0.10 mol·L-1的氨水,
滴定過程中不可能出現的結果是( )
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) |
| B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) |
| D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
水的電離過程為H2O H++OH-,在25 ℃時水的離子積為KW=1.0×10-14,在35 ℃時水的離子積為KW=2.1×10-14,則下列敘述正確的是( )
H++OH-,在25 ℃時水的離子積為KW=1.0×10-14,在35 ℃時水的離子積為KW=2.1×10-14,則下列敘述正確的是( )
| A.c(H+)隨著溫度的升高而降低 |
| B.35 ℃時c(H+)>c(OH-) |
| C.35 ℃時的水比25 ℃時的水電離程度小 |
| D.水的電離是個吸熱過程 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com