
【題目】由乙烯和其他無機原料合成環狀酯E和髙分子化合物H的示意圖如圖所示:
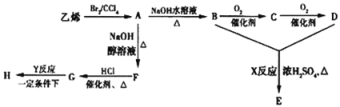
請回答下列問題:
(1)寫出以下物質的結構簡式:B______,G_______
(2)寫出以下反應的反應類型:X_____,Y______.
(3)寫出以下反應的化學方程式:A→B:_______
(4)若環狀酯E與NaOH水溶液共熱,則發生反應的化學方程式為______.
【答案】HOCH2CH2OH;CH2=CHCl 酯化反應 加聚反應 CH2BrCH2Br+2H2O![]() HOCH2CH2OH+2HBr; CH2OHCH2OH+HCCOC﹣COOH
HOCH2CH2OH+2HBr; CH2OHCH2OH+HCCOC﹣COOH![]()
![]() +2H2O
+2H2O ![]() +2NaOH
+2NaOH![]() NaOOCCOONa+HOCH2CH2OH
NaOOCCOONa+HOCH2CH2OH
【解析】
乙烯和溴發生加成反應生成A,A的結構簡式為:CH2BrCH2Br,A和氫氧化鈉的水溶液發生取代反應生成B,B的結構簡式為:HOCH2CH2OH,B被氧氣氧化生成C,C的結構簡式為:OHC-CHO,C被氧氣氧化生成D,D的結構簡式為:HOOC-COOH,B和D發生酯化反應生成E,E是環狀酯,則E乙二酸乙二酯;A和氫氧化鈉的醇溶液發生消去反應生成F,F的結構簡式為:HC≡CH,F和氯化氫發生加成反應生成G氯乙烯,氯乙烯發生加聚反應生成H聚氯乙烯。
根據以上分析,(1)B是乙二醇,B的結構簡式為:HOCH2CH2OH,G氯乙烯,G的結構簡式是CH2=CHCl;
(2)反應X是CH2OHCH2OH與HCCOC﹣COOH生成![]() ,反應類型是酯化反應;反應Y是CH2=CHCl 生成聚氯乙烯,反應類型是加聚反應;
,反應類型是酯化反應;反應Y是CH2=CHCl 生成聚氯乙烯,反應類型是加聚反應;
(3)CH2BrCH2Br和氫氧化鈉的水溶液發生取代反應生成CH2OHCH2OH, 反應的化學方程式是CH2BrCH2Br+2H2O![]() HOCH2CH2OH+2HBr;
HOCH2CH2OH+2HBr;
(4)若環狀酯E與NaOH水溶液共熱發生水解反應,則發生反應的化學方程式為![]() +2NaOH
+2NaOH![]() NaOOCCOONa+HOCH2CH2OH。
NaOOCCOONa+HOCH2CH2OH。


科目:高中化學 來源: 題型:
【題目】為了驗證濃硫酸和木炭粉在加熱條件下產生的氣體產物,某同學選用了如圖所示的實驗裝置。下列說法錯誤的是

A. B裝置用來檢驗產物中是否有水蒸氣
B. 拆除E裝置也能達到實驗目的
C. F裝置中出現白色渾濁證明產物中一定有CO2生成
D. C裝置用來檢驗產物中是否有SO2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含有N、P、Fe、Ti等元素的新型材料有著廣泛的用途。
(1)基態Fe原子未成對電子數為______個;基態Ti原子的價電子排布圖是_____________。
(2)意大利羅馬大學的:FuNvio Cacace等人獲得了極具理論研究意義的N4分子,其中氮原子的軌道雜化形式為__________________________。
(3)比較氣態氫化物膦(PH3)和氨(NH3)的鍵角:PH3________NH3(填“大于”、“小于”或“等于”),主要原因為____________________________________________________________。
(4)半夾心結構催化劑M能催化乙烯、丙烯、苯乙烯的聚合,其結構如圖所示。

①組成M的元素中,電負性最大的是___________(填名稱)。
②M中含有_________(填標號)。
A π鍵 B σ鍵
C 離子鍵 D 配位鍵

(5)已知金剛石的晶胞沿其體對角線垂直在紙平面上的投影圖如下圖B所示,則金屬鐵晶胞沿其體對角線垂直在紙平面上的投影圖應該是圖__________(填標號)。

(6)某種磁性氮化鐵的晶胞結構如圖所示,其中距離鐵原子最近的鐵原子的個數為____________,氮化鐵晶胞底邊長為a cm,高為c cm,則這種磁性氮化鐵的晶體密度為__________g·cm-3(用含a、c和NA的計算式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】pH是溶液中c(H+)的負對數,若定義pC是溶液中微粒物質的量濃度的負對數,則常溫下,某濃度的草酸(H2C2O4)水溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)隨著溶液pH的變化曲線如圖所示:下列說法不正確的是

A. 曲線I代表HC2O4-的濃度隨著pH增大先變小后變大
B. 草酸的電離常數 Kal=l×10-1.3; Ka2= l×10-4.3
C. pH=4時,c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. 
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,圓底燒瓶中盛有 0.18g 鎂條,加入 10.00mL2.00mol/L 的硫酸溶液 反應完全后,產生氫氣 180mL。
(1)根據實驗數據計算,氣體的摩爾體積為_____。
(2)反應過程中,裝置內空氣沒有排除,空氣的體積對實驗結果____(填“有”或“無”)影響,請簡述理由:________
(3)有同學認為:若鎂條中混有雜質,則實驗結果會偏低。請列舉實例分析該同學的觀點是否正確?____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH隨所加NaOH溶液體積的變化圖像如下圖所示。下列說法正確的是

A. 若a點pH=4,且c(Cl-)=m·c(ClO-),則Ka(HClO)=![]()
B. 若x=100,b點對應溶液中:c(OH-)>c(H+),可用pH試紙測定其pH
C. b~c段,隨NaOH溶液的滴入,![]() 逐漸增大
逐漸增大
D. 若y=200,c點對應溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環戊烯是生產精細化工產品的重要中間體,其制備涉及的反應如下:
氫化反應: ,
,![]()
副反應: ,
,![]()
解聚反應: ,
,![]()
回答下列問題:
(1)反應![]() 的△H= _____ kJ/mol。
的△H= _____ kJ/mol。
(2)一定條件下,將環戊二烯溶于有機溶劑進行氫化反應(不考慮二聚反應),反應過程中保持氫氣壓力不變,測得環戊烯和環戊烷的產率(以環戊二烯為原料計)隨時間變化如圖所示:

①0~4h氫化反應速率比副反應快的可能原因是_________。
②最佳的反應時間為__h。若需迅速減慢甚至停止反應,可采取的措施有____(寫一條即可)。
③一段時間后,環戊烯產率快速下降的原因可能是_________。
(3)解聚反應在剛性容器中進行(不考慮氫化反應和副反應)。
①其他條件不變,有利于提高雙環戊二烯平衡轉化率的是 ____(填標號)。
A.增大雙環戊二烯的用量 B.使用催化劑 C.及時分離產物 D.適當提高溫度
②實際生產中常通入水蒸氣以降低雙環戊二烯的溫度(水蒸氣不參與反應)。某溫度下,通入總壓為300 kPa的雙環戊二烯和水蒸氣,達到平衡后總壓為500 kPa,雙環戊二烯的轉化率為80%,則p(H2O)=______kPa,平衡常數Kp=_______kPa (Kp為以分壓表示的平衡常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙苯是重要的化工原料,利用乙苯為初始原料合成高分子化合物J的流程如下圖所示(部分產物及反應條件已略去):
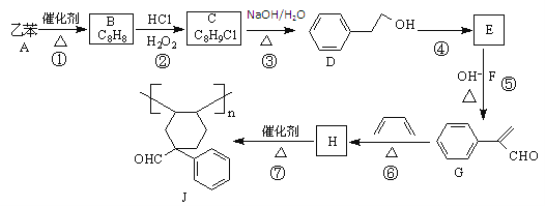
已知:①R1CHO+R2CH2CHO![]()
![]() +H2O
+H2O
②
(1)物質B的名稱為________。反應④所需的試劑和條件分別為____。
(2)②、③的反應類型分別為_______。
(3)物質H中官能團的名稱是_____;物質J的化學式是______。
(4)反應⑤的化學方程式為_____。
(5)寫出符合下列條件,與G互為同分異構體的芳香族化合物的結構簡式:_____。
ⅰ.與Na反應能夠生成氫氣;ⅱ.含碳碳叁鍵(不考慮“![]() ”結構);ⅲ.苯環上只有兩個處于對位的取代基;ⅳ.核磁共振氫譜中峰的面積之比為2:2:2:1:1。
”結構);ⅲ.苯環上只有兩個處于對位的取代基;ⅳ.核磁共振氫譜中峰的面積之比為2:2:2:1:1。
(6)參照上述合成路線和信息,設計由![]() 、乙醛、苯甲醇合成
、乙醛、苯甲醇合成 的路線_______(無機試劑任選)。
的路線_______(無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中導電性最強的是( )
A. 1 L 0.1 mol/L AlCl3溶液 B. 0.1 L 0.1 mol/L H2SO4溶液
C. 0.5 L 0.15 mol/L鹽酸 D. 2 L 0.1 mol/L H2SO3溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com