
【題目】酯類是工業上重要的有機原料,具有廣泛用途。下圖是乙酸乙酯的合成路線圖,已知A能與銀氨溶液反應析出銀鏡,B的水溶液可以溶解CaCO3,E可作果實催熟劑。

請完成下列問題:
(1)A的名稱是_________;B中所含的官能團是____________;反應③的類型是_____________;反應④的類型是_____________。
(2)A的結構簡式為___________________;E的結構簡式為_________________________。
(3)請寫出反應①、③、④的化學方程式:
①__________________________________________________________。
③__________________________________________________________。
④__________________________________________________________。
【答案】 乙醛 羧基(或—COOH) 酯化(或取代反應) 加成反應 CH3CHO CH2=CH2 2CH3CH2OH + O2![]() 2CH3CHO+2H2O CH3CH2OH + CH3COOH
2CH3CHO+2H2O CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 +H2O CH2=CH2 + HCl
CH3COOCH2CH3 +H2O CH2=CH2 + HCl![]() CH3CH2Cl
CH3CH2Cl
【解析】試題分析:乙醇能被氧氣氧化為乙醛,A能與銀氨溶液反應析出銀鏡,所以A是乙醛;乙醛能氧化為乙酸, B的水溶液可以溶解CaCO3,所以B是乙酸,E可作果實催熟劑,E是乙烯;氯乙烷在氫氧化鈉水溶液中加熱生成乙醇,C是乙醇,乙酸、乙醇發生酯化反應生成乙酸乙酯。
解析:根據以上分析,(1)A的名稱是乙醛;B是乙酸,含的官能團是羧基;乙酸、乙醇發生反應生成乙酸乙酯和水,類型是酯化(或取代反應);乙烯與氯化氫反應生成氯乙烷,反應類型是加成反應。
(2)乙醛的結構簡式為CH3CHO;乙烯的結構簡式為CH2=CH2。
(3)請寫出反應①、③、④的化學方程式:
①乙醇氧化為乙醛的方程式為2CH3CH2OH + O2![]() 2CH3CHO+2H2O 。
2CH3CHO+2H2O 。
③乙酸、乙醇發生反應生成乙酸乙酯和水的方程式為CH3CH2OH + CH3COOH![]() CH3COOCH2CH3 +H2O 。
CH3COOCH2CH3 +H2O 。
④乙烯與氯化氫反應生成氯乙烷的方程式為CH2=CH2 + HCl![]() CH3CH2Cl。
CH3CH2Cl。


科目:高中化學 來源: 題型:
【題目】加成反應也是有機化學中的一類重要的反應類型,下列物質各組物質中不能全部發生加成反應的是 ( )
A. 乙烷、乙烯 B. 乙烯、乙炔 C. 氯乙烯、溴乙烯 D. 苯、2-丁烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在一定條件下,體積為2L的密閉容器中,發生如下反應:N2(g)+3H2(g)![]() 2NH3(g),起始時,充入的N2和H2的物質的量分別是3.0 mol和6.0 mol,3min后達到平衡,生成NH3的物質的量是2.4 mol。試求:
2NH3(g),起始時,充入的N2和H2的物質的量分別是3.0 mol和6.0 mol,3min后達到平衡,生成NH3的物質的量是2.4 mol。試求:
① 3min內用N2表示的化學反應速率為____________。②H2的轉化率是____________。
(2)某化學實驗小組的同學為探究和比較SO2和氯水的漂白性,設計了如下的實驗裝置。
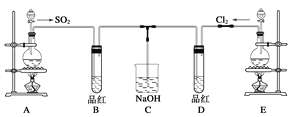
a.實驗室用裝置E制備Cl2,其反應的化學方程式為:MnO2+4HCl(濃)![]() MnCl2+Cl2+2H2O。若有6 mol 的HCl參加反應,則轉移的電子物質的量為____________;
MnCl2+Cl2+2H2O。若有6 mol 的HCl參加反應,則轉移的電子物質的量為____________;
b.①反應開始一段時間后,觀察到D試管中的品紅溶液出現的現象是:
D:_____________________________________________________________。
②停止通氣后,再給B、D兩個試管分別加熱;兩個試管中的現象分別為:
B:____________________________________,D:________________________________。
c.另一個實驗小組的同學認為SO2和氯水都有漂白性,二者混合后的漂白性肯定會更強。他們將制得的SO2和Cl2按1∶1同時通入到品紅溶液中,結果發現褪色效果并不像想象的那樣。請你分析該現象的原因(用化學方程式表示)_______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為周期表的一小部分,A、B、C、D的位置關系如圖所示。且它們均為短周期元素,其中C元素的最外層電子數是電子層數的2倍,回答下列問題:

(1)在B、C、D最高價氧化物對應水化物中,B的化學式為______,其中酸性最強的是_____。
(2)在A、B、C、所形成氫化物中,A的化學式:___________,其中最穩定的是___________。
(3)寫D的單質與C的氫化物反應的化學方程式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于漂白粉的敘述正確的是( )
A.漂白粉的有效成分是Ca(ClO)2和CaCl2
B.漂白粉在空氣中久置后會變質
C.漂白粉是由Cl2與燒堿制得的
D.在使用漂白粉時應用濃鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】與鏈烴相比,苯的化學性質的主要特征為 ( )
A. 難氧化、難取代、難加成 B. 易氧化、易取代、易加成
C. 難氧化、易取代、難加成 D. 易氧化、易取代、難加成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,100 ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH減小,但又要使醋酸電離程度減少,應采取( )
A.加入少量CH3COONa固體 B.通入少量氯化氫氣體
C.升高溫度 D.加入少量氫氧化鈉固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業制硫酸的過程中,SO2催化氧化的原理為:2SO2(g) + O2(g) ![]() 2SO3(g) + Q
2SO3(g) + Q ![]()
(1)若溫度從300℃升至400℃,重新達到平衡,判斷下列表格中各物理量的變化。(選填“增大”、“減小”或“不變”)
|
| 平衡常數K |
________ | ________ | ________ |
(2)2SO2(g) + O2(g) ![]() 2SO3(g)過程的能量變化如圖所示。下列說法正確的是_________
2SO3(g)過程的能量變化如圖所示。下列說法正確的是_________
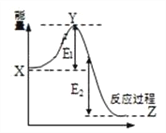
A.加入催化劑,X點位置升高
B.反應熱 = E1 + E2
C.反應物總能量低于生成物
D.加入催化劑,E2不變
(3)將一定量的SO2(g)和O2(g)分別通入到體積為2L的恒容密閉容器中,在不同溫度下進行反應得到如下表中的兩組數據:
實驗編號 | 溫度/℃ | 起始量/mol | 平衡量/mol | ||
SO2 | O2 | SO2 | O2 | ||
1 | T1 | 4 | 2 | x | 0.8 |
2 | T2 | 4 | 2 | 0.4 | y |
實驗1從開始到反應達到化學平衡時,用去時間2分鐘,則υ(SO2)表示的反應速率為_________;T1________T2(填“>”、“<”或“=”)。制取SO2的尾氣用NaOH溶液吸收,可得到Na2SO3和NaHSO3兩種鹽。
(4)0.1mol/L的NaHSO3溶液中c(H+) > c(OH-),用水解和電離理論的角度解釋其原因___________________;若往溶液中加入氨水至中性,則c(Na+)______c(HSO3-) + c(SO32-) + c(H2SO3)(填“>”、“﹤”或“=”)。
(5)往0.1 mol/L的Na2SO3溶液加入少量Na2SO3固體,完全溶解后溶液中c(Na+) : c(SO32-)的比值____________(填“變大”、“變小”或“保持不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com