
【題目】如圖是室溫下,向100mL鹽酸中逐漸加入NaOH溶液時,溶液的pH變化圖象.根據圖象所得結論正確的是( ) 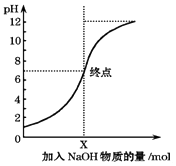
A.原來鹽酸的物質的量濃度為0.1mol/L
B.NaOH溶液的濃度為0.1mol/L
C.pH=1和pH=7的點對應溶液中水的電離程度相同
D.X點NaOH溶液的體積為100mL
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】下列化學方程式不正確的是( )
A.CH3CO18OC2H5+H2O ![]() CH3COOH和C2H518OH
CH3COOH和C2H518OH
B.溴乙烷與氫氧化溶液共熱:CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
C.蔗糖水解: ![]() +H2O
+H2O ![]()
![]()
D.苯酚鈉中通入二氧化碳: ![]() +CO2+H2O→
+CO2+H2O→ ![]() +NaHCO3
+NaHCO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據問題填空:
(1)鋼鐵很容易生銹而被腐蝕,每年因腐蝕而損失的鋼鐵占世界鋼鐵年產量的四分之一. 
①鋼鐵腐蝕主要是吸氧腐蝕,該腐蝕過程中的正極反應式為 .
②為了降低某水庫的鐵閘門被腐蝕的速率,可以采用如圖甲所示的方案,其中焊接在鐵閘門上的固體材料 R 可以采用 .
A.銅B.錫C.鋅D.石墨
③如圖乙方案也可以降低鐵閘門的腐蝕速率,其中鐵閘門應該連接在直流電源的極上.
(2)根據反應 Fe+Fe2(SO4)3═3FeSO4設計的雙液原電池如圖丙所示.
①電極Ⅰ的材料為金屬鐵,則燒杯 A 中的電解質溶液為(填化學式)
②電極Ⅱ發生的電極反應式為 .
(3)某同學組裝了如圖丁所示的電化學裝置.電極Ⅰ為 Al,其他電極均為 Cu. ①電極Ⅰ為極(填“正”“負”或“陰”“陽”),發生反應(填“氧化”或“還 原”),電極反應式為;電極Ⅲ為極(填“正”“負”或“陰”“陽”).
②鹽橋中盛有含 KNO3 溶液的瓊脂,鹽橋中的 K+向極(填“Ⅰ”或“Ⅱ”)移動.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2的綠色減排、捕捉、轉化是人類可持續發展的重要戰略之一。
(1)CO2來源之一是汽車尾氣
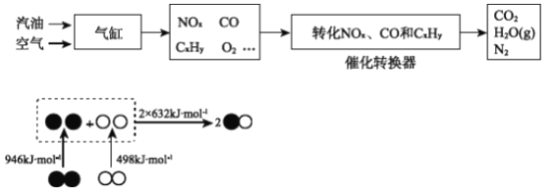

①根據上圖,寫出氣缸內產生NO的熱化學方程式________。
②寫出轉換器中在催化劑作用下NOx和CO反應的化學方程式________。
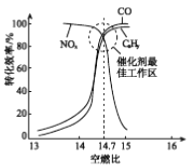
③在催化轉換器中機動車尾氣轉化效率與空燃比(空氣與燃油氣的體積比)的關系如右圖。若空燃比小于14.7,氧氣不足,CxHy和CO不能被完全氧化,導致其轉化效率降低;若空燃比大于14.7,則NOx的轉化效率降低,原因是________。
(2)利用NaOH溶液可以“捕捉” CO2
已知:0.448L CO2(已折算標準狀況)被NaOH溶液充分吸收,得到100mL含有Na2CO3和NaHCO3的吸收液。
①向吸收液中加入足量BaCl2溶液得到沉淀,經過濾、洗滌、干燥后,稱重為1.97g,則吸收液中c(Na2CO3) = ________。(該條件下NaHCO3與BaCl2不反應)
②對該吸收液,下列判斷正確的是________。
a . c (CO32- ) > c (HCO3- )
b. 2c (CO32- ) + c (HCO3- ) + c (OH- ) = c (H+ ) + c (Na+ )
c. c (H2CO3) + c (HCO3- ) + c (CO32- ) =0.2molL-1
(3)工業上可用CO2來制甲醇
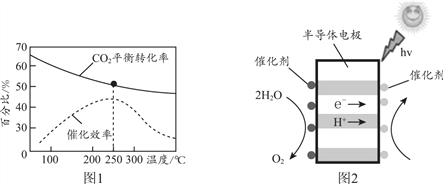
①CO2 (g) + 3H2(g) ![]() CH3OH(g) + H2O(g) ΔH < 0
CH3OH(g) + H2O(g) ΔH < 0
根據圖1分析,實際工業生產中,反應溫度選擇250℃的理由________。
②利用光電催化原理,由CO2和H2O制備CH3OH的裝置如圖2。寫出右側的電極反應式________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】a.某有機物A化學式為CxHyOz,15 gA完全燃燒生成22 gCO2和9 gH2O。試確定:
(1)該有機物的最簡式______________;
(2)若A的相對分子質量為60且和Na2CO3混合有氣體放出,A和醇能發生酯化反應,則A的結構簡式為 _______________ ;
(3)若A的相對分子質量為60且是易揮發有水果香味的液體,能發生水解反應,則其結構簡式為______________;
(4)若A分子結構中含有6個碳原子,具有多元醇和醛的性質,則其結構簡式為_______。
b.有機物A、B、C、D在一定條件下有如圖所示的轉化關系:

請回答下列有關問題:
(1)寫出B的分子式:____________________。
(2)分別寫出反應①的反應方程式______________和②的反應方程式________________________
(3)③的反應類型為___________________________。
(4)兩分子D在濃硫酸存在的條件下加熱可以發生自身的酯化反應生成E或F,且E的相對分子質量比F的小,則E和F的結構簡式分別為___________________、_________________。
(5)下列關于有機物A的說法正確的有__________________(填序號)。
a.含有氫氧根離子,具有堿性
b.能發生加聚反應
c.能使溴水褪色
d.在一定條件下能與冰醋酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質所發生的化學反應中,由于反應物的用量不同而得到不同產物的是( )
①鐵與稀硝酸②碳酸鈉溶液與稀鹽酸③鋁和NaOH溶液④鐵與氯氣
A.①②B.①②③④C.①③D.①③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用0.1032molL﹣1 HCl溶液滴定未知濃度的NaOH溶液,
(1)某同學按下列步驟進行實驗:①取一錐形瓶,用待測NaOH溶液潤洗兩次; ②在錐形瓶中加入 25,.00 mL待測NaOH溶液;③加入幾滴石蕊試劑做指示劑;④取一支酸式滴定管,洗滌干凈; ⑤直接往酸式滴定管中注入標準酸溶液,進行滴定; ⑥兩眼注視著滴定管內鹽酸溶液液面下降,直至滴定終點.
其中所述操作有錯誤的序號為
(2)取用25.00 mL待測NaOH溶液應用以下(選填:“甲”、“乙”)裝置,若取用NaOH溶液開始平視讀數、結束時俯視讀數,會導致所測氫氧化鈉溶液濃度(填“偏大““偏小“或“不變“) ![]()
(3)若滴定開始前滴定管尖嘴中有一氣泡,滴定結束后氣泡消失, 則會導致所測氫氧化鈉溶液濃度(填“偏大““偏小“或“不變“)
(4)若平行實驗三次,記錄的數據如下表
滴定次數 | 待測溶液的體積(/mL) | 標準HCl溶液的體積 | |
滴定前讀數(/mL) | 滴定后讀數(/mL) | ||
① | 25.00 | 1.02 | 21.04 |
② | 25.00 | 2.00 | 22.98 |
③ | 25.00 | 0.20 | 20.18 |
試計算待測NaOH溶液的物質的量濃度(列出計算過程).
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com