
【題目】有4種鈉的化合物W、X、Y、Z,它們之間存在如下關系:
① W![]() X + H2O + CO2↑
X + H2O + CO2↑
② Z + CO2 → X + O2
③ Z + H2O → Y + O2↑
④ X + Ca(OH)2 → Y+ CaCO3↓
試回答下列問題:
(1)W、X、Y、Z的化學式分別是:W_____________,X_____________,Y_____________,Z_____________。
(2)以上4個化學反應,屬于氧化還原反應的是__________________________(填反應序號)。在反應③中氧化劑是___________________(寫化學式),還原劑是_____________(寫化學式),寫出反應②化學方程式并雙線橋法標出電子轉移方向、數目_______________________________________。
(3)若④反應在溶液中進行,寫出其離子方程式__________________________。
【答案】NaHCO3 Na2CO3 NaOH Na2O2 ②③ Na2O2 Na2O2  CO32-+Ca2+=CaCO3↓
CO32-+Ca2+=CaCO3↓
【解析】
根據框圖所示的內容,鈉的化合物中,受熱能分解生成三種產物的是碳酸氫鈉,所以W是碳酸氫鈉,碳酸氫鈉受熱分解生成碳酸鈉、水和二氧化碳,所以X是碳酸鈉,能和二氧化碳以及水反應生成氧氣的是過氧化鈉,所以Z是過氧化鈉,以此解答。
(1)根據框圖所示的內容,鈉的化合物中,受熱能分解生成三種產物的是碳酸氫鈉,所以W是碳酸氫鈉,碳酸氫鈉受熱分解生成碳酸鈉、水和二氧化碳,所以X是碳酸鈉,能和二氧化碳以及水反應生成氧氣的是過氧化鈉,所以Z是過氧化鈉,故答案為:NaHCO3;Na2CO3;NaOH;Na2O2;
(2)以上4個化學反應中,反應2Na2O2+2CO2=2Na2CO3+O2↑和2Na2O2+2H20=4NaOH+O2↑中有元素化合價的變化,屬于氧化還原反應,兩個反應中化合價變化的均是過氧化鈉中的氧元素,所以過氧化鈉既是氧化劑又是還原劑,②化學方程式并雙線橋法標出電子轉移方向、數目為: ,故答案為:②③;Na2O2;Na2O2;
,故答案為:②③;Na2O2;Na2O2; 。
。
(3)碳酸鈉和氫氧化鈣反應的離子方程式為:CO32-+Ca2+=CaCO3↓故答案為:CO32-+Ca2+=CaCO3↓。


科目:高中化學 來源: 題型:
【題目】某化學興趣小組利用NaI溶液中通入少量Cl2得到含碘廢液,再利用含碘廢液獲取NaI固體,實驗流程如下:

已知反應②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列問題:
(1)過濾實驗所需要的玻璃儀器有普通漏斗、燒杯、_____________。
(2)反應③中CuI被氧化,還原產物只有NO2,該反應的化學方程式為_________________。當有95.5 g CuI參與反應,則需要標況下______________L的O2才能將生成的NO2在水中完全轉化為硝酸。
(3)化合物B中含兩種元素,鐵原子與另一種元素原子的物質的量之比為3∶8,則化合物B的化學式為_____________。
(4)反應⑤中生成黑色固體和無色氣體,黑色固體的俗稱為磁性氧化鐵,則反應⑤的化學方程式為______。
(5)將足量的Cl2通入含12 g NaI的溶液中,一段時間后把溶液蒸干得到固體的質量為_________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚維酮碘的水溶液是一種常用的碘伏類緩釋消毒劑,聚維酮通過氫鍵與HI3形成聚維酮碘,其結構表示如圖 ,下列說法不正確的是( )
,下列說法不正確的是( )
A.聚維酮的單體是![]() B.聚維酮分子由(m+n)個單體聚合而成
B.聚維酮分子由(m+n)個單體聚合而成
C.聚維酮碘是一種水溶性物質D.聚維酮在一定條件下能發生水解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家利用太陽能分解水生成的氫氣在催化劑作用下與CO2反應生成甲醇。已知:H2(g)、CO(g)和CH3OH(l)的燃燒熱ΔH分別為285.8kJ·mol1、283.0kJ·mol1和726.5kJ·mol1。
請回答下列問題:
(1)用太陽能分解10mol水消耗的能量是______kJ。
(2)寫出表示H2(g)、CO(g)和CH3OH(l)燃燒熱的熱化學方程式。
①H2:__________;
②CO:__________;
③CH3OH:_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請結合題中數據,寫出對應的熱化學方程式。
(1)16gCH3OH(l)與適量O2反應,生成CO2(g)和H2O(l),放出683.4kJ熱量_____。
(2)N2(g)和H2(g)反應生成2 molNH3(g),放出92.2kJ熱量_____。
(3)稀溶液中,1molH2SO4與NaOH完全反應時,放出114.6kJ熱量,寫出表示中和熱的熱化學方程式_______。
(4)agC(s)與足量O2反應生成CO2氣體時,放出bkJ熱量____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(AlN,Al和N的相對原子質量分別為27和14)廣泛用于電子、陶瓷等工業領域。在一定條件下,AlN可通過反應Al2O3+N2+3C![]() 2AlN+3CO合成。下列敘述正確的是( )
2AlN+3CO合成。下列敘述正確的是( )
A.上述反應中,N2是還原劑,Al2O3是氧化劑
B.上述反應中,每生成1mol AlN需轉移3mol電子
C.AlN中氮元素的化合價為+3
D.AlN的摩爾質量為41g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的原電池,下列敘述正確的是(鹽橋中裝有含瓊膠的KCl飽和溶液)( )
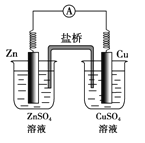
A. 反應中,鹽橋中的K+會移向CuSO4溶液
B. 取出鹽橋后,電流計依然發生偏轉
C. 銅片上有氣泡逸出
D. 反應前后銅片質量不改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某條件下N2與H2反應過程中能量變化的曲線圖.根據圖象判斷下列敘述中正確的是( )
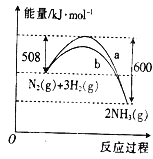
A. 該反應的熱化學方程式為N2(g)+3H2(g)![]() 2NH3(g) △H=+92kJ·mol﹣1
2NH3(g) △H=+92kJ·mol﹣1
B. a曲線是加入催化劑時的能量變化曲線
C. 加入催化劑,該化學反應的反應熱數值會減小
D. 反應2NH3(g)![]() N2(g)+3H2(g)△H=+92kJ·mol﹣1
N2(g)+3H2(g)△H=+92kJ·mol﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在恒溫恒容的密閉體系中,可逆反應:A(s)+2B(g)![]() 2C(g) ΔH<0,不能作為該反應達到化學平衡的標志的是
2C(g) ΔH<0,不能作為該反應達到化學平衡的標志的是
①v正(B)=v逆(C) ②n(B)∶n(C)=1∶1 ③容器內壓強不再改變
④容器內氣體的密度不再改變 ⑤容器內混合氣體的平均相對分子質量不再改變
A. ②③④⑤ B. ①③④ C. ②③ D. 全部
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com