
【題目】砷化鎵(GaAs)是優良的半導體材料,可用于制作微型激光器或太陽能電池的材料等。回答下列問題:
(1)寫出基態As原子的核外電子排布式________________________。
(2)根據元素周期律,原子半徑Ga_____________As,第一電離能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立體構型為____________________,其中As的雜化軌道類型為_________。
(4)GaF3的熔點高于1000℃,GaCl3的熔點為77.9℃,其原因是_____________________。
(5)GaAs的熔點為1238℃,密度為ρg·cm-3,其晶胞結構如圖所示。該晶體的類型為________________,Ga與As以________鍵鍵合。Ga和As的摩爾質量分別為MGa g·mol-1和MAs g·mol-1,原子半徑分別為rGa pm和rAs pm,阿伏伽德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為____________________。

【答案】 ![]() 大于 小于 三角錐形 sp3 GaF3是離子晶體,GaCl3是分子晶體,離子晶體GaF3的熔沸點高 原子晶體 共價鍵
大于 小于 三角錐形 sp3 GaF3是離子晶體,GaCl3是分子晶體,離子晶體GaF3的熔沸點高 原子晶體 共價鍵 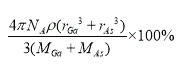
【解析】試題分析: (1)As為ⅤA族33號元素,電子排布式為:1s22s22p63s23p63d104s24p3;
(2)同一周期,原子序數越小半徑越大,同周期第一電離能從左到右,逐漸增大;
(3)AsCl3中價層電子對個數=σ鍵個數+孤電子對個數=3+1 =4,所以原子雜化方式是sp3,由于有一對孤對電子對,分子空間構型為三角錐形;
(4)GaF3的熔點高于1000℃,GaCl3的熔點為77.9℃,其原因是GaF3為離子晶體,GaCl3為分子晶體,離子晶體的熔點高;
(5)GaAs的熔點為1238℃,熔點較高,以共價鍵結合形成屬于原子晶體,密度為ρ g![]() cm﹣3,根據均攤法計算,As:
cm﹣3,根據均攤法計算,As: ![]() ,Ga:4×1=4,rGapm和rAspm,故其晶胞中原子所占的體積V1=
,Ga:4×1=4,rGapm和rAspm,故其晶胞中原子所占的體積V1=![]() ×10﹣30,1個晶胞的體積V2=
×10﹣30,1個晶胞的體積V2= ![]() ,將V1、V2帶入計算 GaAs晶胞中原子的體積占晶胞體積的百分率。
,將V1、V2帶入計算 GaAs晶胞中原子的體積占晶胞體積的百分率。
解析:根據以上分析,(1)As為ⅤA族33號元素,電子排布式為:1s22s22p63s23p63d104s24p3;
(2)根據元素周期律,Ga與As位于同一周期,Ga原子序數小于As,故半徑Ga大于As,同周期第一電離能從左到右,逐漸增大,故第一電離能Ga小于As;
(3)AsCl3中價層電子對個數=σ鍵個數+孤電子對個數=3+1 =4,所以原子雜化方式是sp3,由于有一對孤對電子對,分子空間構型為三角錐形;
(4)GaF3的熔點高于1000℃,GaCl3的熔點為77.9℃,其原因是GaF3為離子晶體,GaCl3為分子晶體,離子晶體的熔點高;
(5)GaAs的熔點為1238℃,熔點較高,以共價鍵結合形成屬于原子晶體,密度為ρ gcm﹣3,根據均攤法計算,As: ![]() ,Ga:4×1=4,故其晶胞中原子所占的體積V1=
,Ga:4×1=4,故其晶胞中原子所占的體積V1=![]() ×10﹣30,晶胞的體積V2=
×10﹣30,晶胞的體積V2= ![]() ,故GaAs晶胞中原子的體積占晶胞體積的百分率為 將V1、V2帶入計算得百分率=
,故GaAs晶胞中原子的體積占晶胞體積的百分率為 將V1、V2帶入計算得百分率= 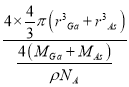 ×100%=
×100%=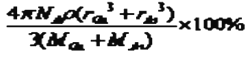 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】乙烯的產量通常用來衡量一個國家的石油化工水平。請回答下列問題。
(1)乙烯的結構簡式為_________。
(2)可以區別甲烷和乙烯的試劑是_________(填正確選項的編號)。
A.濃硫酸 B.碳酸鈉溶液 C.溴的四氯化碳溶液 D.酸性高錳酸鉀溶液
(3)CH3CH3可以通過乙烯和_________反應生成。
(4)已知 2CH3CHO+ O2![]() 2CH3COOH。若以乙烯為主要原料合成乙酸,其合成路線如下所示:
2CH3COOH。若以乙烯為主要原料合成乙酸,其合成路線如下所示:
反應②的化學方程式為______________________。
工業上以乙烯為原料生產聚乙烯的化學方程式為_________,反應類型屬于_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,我國在超導研究方面居世界領先地位,鉈(Tl)是超導體的組成成分之一,鉈位于第6周期ⅢA族,下列對鉈的性質推導可能正確的是( )
①鉈是易導電的銀白色金屬
②Tl(OH)3是兩性氫氧化物
③Tl3+的氧化能力比Al3+的強
④單質能跟稀HNO3反應生成硝酸鹽
A. ①④ B. ②③ C. 只有① D. 只有④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種元素的電子層數相同,它們的最高價氧化物分別為酸性氧化物、堿性氧化物和兩性氧化物,則三種元素的原子序數的大小順序是( )
A. X>Y>Z B. Y>Z>X
C. X>Z>Y D. Z>X>Y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我們利用物質的結構與性質對周期表進行研究,有助于我們更好地掌握同類知識。
(1)基態砷原子中,價電子占用_________個原子軌道;雌黃分子式為As2S3,分子結構如圖,則As原子的雜化方式為_________ 。

(2)N2與CO互為等電子體,則1molCO分子中含有的π鍵數目是_________個。
(3)向CuSO4溶液中加人少量氨水生成藍色沉淀,繼續加人過量氨水沉淀溶解,得到深藍色透明溶液,最后向該溶液中加人一定量乙醇,析出[Cu(NH3)4]SO4 .H2O晶體;該晶體所含的非金厲元素中,N、O、S第一電離能由大到小的順序是_________ (填元素符號),SO42-的空間構型為____________,晶體中含有的化學鍵有__________。加人乙醇后析出[Cu(NH3)4]SO4 .H2O晶體的原因是____________。
(4)常溫下PCl5是一種白色晶體,其立方晶系晶體結構模型如下左圖所示,由A、B兩種微粒構成。 將其加熱至148℃熔化,形成一種能導電的熔體。已知A微粒與CCl4具有相同的空間構型和相似的化學鍵特征,則A為_________ , B為_______________。
(5)磷化硼(BP)是一種超硬耐磨涂層材料,下右圖為其立方晶胞。已知晶體中最近的硼原子和磷原子核間距為x cm,磷化硼的摩爾質量為bg.·mol-1,阿伏加德羅常數為NA,則磷化硼晶體密度的表達式
為____________g.cm-3。(列出計算式即可)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A. Na2O2與H2O反應:2![]() +2H2O4OH-+O2↑
+2H2O4OH-+O2↑
B. 金屬鈉投入水中:Na+2H2O=Na++OH-+H2↑
C. CaCO3與醋酸溶液反應:CaCO3+2H+Ca2++CO2↑+H2O
D. KAl(SO4)2溶液與氨水反應:Al3++3NH3·H2OAl(OH)3↓+3N![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按如圖所示裝置進行實驗,以制取乙酸乙酯。
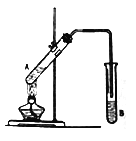
(1)試管A中的液體由以下試劑混合而成:①2mL乙醇;②3mL濃硫酸;③2mL 乙酸。一般況下,這三種試劑的加入順序是:先加入________(填序號,下同),再加入_________,最后加入③。
(2)為防止試管A中的液體在實驗時發生暴沸,在加熱前還應加入碎瓷片。若加熱后發現未加入碎瓷片,應采取的補救措施是:_________________________________________________________。
(3)試管B中盛放的試劑是___________________;反應結束后,分離B中的液體混合物需要用到的玻璃儀器主要是_____________。試管B中的導管末端不伸入液面下方的目的是_______________。
(4)試管 A中CH3COOH與C2H518OH反應的化學方程式為:___________________________________。
(5)該實驗中用30gCH3COOH與46gC2H5OH反應,如果實際得到的乙酸乙酯的質量是26.4g,該實驗中乙酸乙酯的產率是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵及其化合物在生產和生活中有廣泛的應用。
Ⅰ、高鐵酸鈉(Na2FeO4)是一種新型凈水劑,工業上制備高鐵酸鈉的反應原理為:
Fe(OH)3 + NaClO + NaOH →Na2FeO4 + X + H2O(未配平), 則X的電子式為_______ ,反應中被氧化的物質是_________(寫化學式)。
Ⅱ、鐵紅顏料跟某些油料混合,可以制成防銹油漆。工業制硫酸產生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制備鐵紅(Fe2O3)的過程如下:
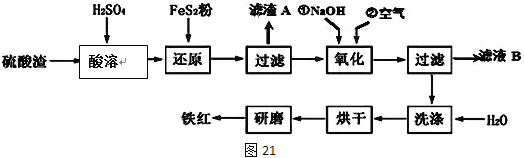
已知:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
開始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
已知FeS2是一種黃色難溶于水的固體。
(1)酸溶過程中Fe2O3與稀硫酸反應的化學方程式為______________________;
“濾渣A”主要成份的化學式為__________________。
(2)還原過程中加入FeS2的目的是將溶液中的Fe3+還原為Fe2+,而本身被氧化為H2SO4,寫出該反應的離子方程式_________________。
(3)為確保鐵紅的質量和純度,氧化過程中加NaOH調節溶液pH的范圍是____;如果加NaOH調節溶液pH=a,則濾液B中c(Fe3+)=____mol/L(25℃時,Ksp[Fe(OH)3]=4×10﹣38)
(4)以甲醚、空氣、氫氧化鉀溶液為原料,石墨為電極可以構成燃料電池。該電池負極的電極反應式為________________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com