
【題目】二氧化硫和硫化氫都是有毒物質,但它們在工業上都有著重要的用途。請回答下列有關問題:
(1)燃煤脫疏是科研工作者研究的重要課題之一,己知有兩種脫硫方法,一是活性炭作化氧化法脫流;二是CO還原法脫硫。
①活性炭在反應過程中作為催化劑,改變了______(填選項字母)。
a.反應限度 b.反應速率 c.反應活化能 d.反應焓變 e.反應路徑
②CO還原法的原理是:2CO(g)+SO2(g)![]() S(g)+2CO2(g),△H。
S(g)+2CO2(g),△H。
已知:S(g)+O2(g)=SO2(g),△H1=-574.0kJ/mol,CO的燃燒熱為283.0kJ/mol,則△H=___。
③在兩個容積為10L的恒容絕熱密閉容器中發生反應:
2CO(g)+SO2(g)![]() S(g)+2CO2(g),各起始反應物的物質的量如右表所示,起始溫度均為T℃。兩容器中平衡常數K甲______K乙(填“>”“=”或“<”),理由是__________。
S(g)+2CO2(g),各起始反應物的物質的量如右表所示,起始溫度均為T℃。兩容器中平衡常數K甲______K乙(填“>”“=”或“<”),理由是__________。

(2)H2S受熱發生分解反應:2H2S(g)=2H2(g)+S2(g),在密閉容器中,充入0.20molH2S(g),壓強為p時,控制不同的溫度進行實驗,H2S的平衡轉化率如圖所示。

①出強為p,溫度為T6℃時,反應經tmin達到平衡,則平均反應速率v(S2)=_______mol/min.
②若壓強p=aMPa,溫度為T4℃時,該反應的平衡常數Kp=____(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)
(3)H2S廢氣可用足量燒堿溶液吸收,將吸收后的溶液加入由惰性電極組成的電解池中進行電解,陽極區可生成Sx2-。請寫出生成Sx2-的電極反應式____________。
【答案】 bce +8.0kJ/mol < 該反應的正反應為吸熱反應,甲、乙相比,甲的正向進行程度大,吸牧的熱量多,溫度低,則K甲<K乙 0.05/t ![]() xS2--2(x-1)e-=Sx2-
xS2--2(x-1)e-=Sx2-
【解析】(1)①活性炭在反應過程中作為催化劑,改變了反應速率、反應活化能、反應路徑;不能改變反應的反應限度和反應焓變;正確選項bce。
②S(g)+O2(g)=SO2(g) △H1=-574.0kJ/mol,②CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJmol-1,將②×2-①得:2CO(g)+SO2(g)![]() S(g)+2CO2(g) △H=2×(-283.0kJmol-1)-(-574.0kJ/mol)= +8.0kJ/mol;正確答案:+8.0kJ/mol;
S(g)+2CO2(g) △H=2×(-283.0kJmol-1)-(-574.0kJ/mol)= +8.0kJ/mol;正確答案:+8.0kJ/mol;
③2CO(g)+SO2(g)![]() S(g)+2CO2(g),△H=+8.0kJ/mol,該反應為吸熱反應,在恒容絕熱密閉容器中發生反應,甲、乙相比,甲的正向進行程度大,吸牧的熱量多,溫度低,向右進行的程度小,因此K甲<K乙;正確答案:<;該反應的正反應為吸熱反應,甲、乙相比,甲的正向進行程度大,吸牧的熱量多,溫度低,則K甲<K乙。
S(g)+2CO2(g),△H=+8.0kJ/mol,該反應為吸熱反應,在恒容絕熱密閉容器中發生反應,甲、乙相比,甲的正向進行程度大,吸牧的熱量多,溫度低,向右進行的程度小,因此K甲<K乙;正確答案:<;該反應的正反應為吸熱反應,甲、乙相比,甲的正向進行程度大,吸牧的熱量多,溫度低,則K甲<K乙。
(2)①在密閉容器中,充入0.20molH2S(g),發生2H2S(g)=2H2(g)+S2(g)反應,進行到T6℃時,硫化氫的轉化率為50%,因此H2S的消耗量為0.20×50%=0.10 mol,生成S2(g)的量為1/2×0.10=0.05 mol,反應經tmin達到平衡,則平均反應速率v(S2)=0.05/tmol/min;正確答案:0.05/t。
②發生2H2S(g)=2H2(g)+S2(g)反應,溫度為T4℃時,硫化氫的轉化率為40%,H2S的消耗量為0.20×40%=0.08 mol,剩余硫化氫的量為2-0.08=0.12 mol,生成H2的量為0.08 mol,生成S2的量為0.04 mol,則若壓強p=aMPa時,硫化氫的分壓為a/2,H2的分壓為a/3,S2的分壓為a/6,該反應的平衡常數Kp=(a/3)2×a/6/ (a/2)2=![]() ;正確答案:
;正確答案:![]() 。
。
(3)H2S電解,陰極上氫離子放電生成氫氣,陽極S2-失電子發生氧化反應生成Sx2-,極反應式為xS2--2(x-1)e-=Sx2-;正確答案:x-2(x-1)e-=Sx2-。


 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:
【題目】碳、氮和鋁的單質及其化合物在工農業生產和生活中有重要的作用.
(1)真空碳熱還原![]() 氯化法可實現由鋁礦制備金屬鋁,其相關的熱化學方程式如下:
氯化法可實現由鋁礦制備金屬鋁,其相關的熱化學方程式如下:
![]()
![]()
![]()
反應![]() 的
的![]() ___________
___________![]() 用含a、b的代數式表示
用含a、b的代數式表示![]() ;
;
(2)用活性炭還原法可以處理氮氧化物![]() 某研究小組向某密閉容器中加入一定量的活性炭和NO,發生反應
某研究小組向某密閉容器中加入一定量的活性炭和NO,發生反應![]()
![]() 在
在![]() 時,反應進行到不同時間測得各物質的濃度如下:
時,反應進行到不同時間測得各物質的濃度如下:

![]() 內,NO的平均反應速率
內,NO的平均反應速率![]() ________________,
________________,![]() 時,該反應的平衡常數
時,該反應的平衡常數![]() _______________;
_______________;
![]() 后,只改變某一條件,反應重新達到平衡,根據上表中的數據判斷改變的條件可能是 ___________
后,只改變某一條件,反應重新達到平衡,根據上表中的數據判斷改變的條件可能是 ___________ ![]() 填字母編號
填字母編號![]() .
.
![]() 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭
![]() 加入合適的催化劑
加入合適的催化劑 ![]() 適當縮小容器的體積
適當縮小容器的體積
![]() 若30min后升高溫度至
若30min后升高溫度至![]() ,達到平衡時,容器中NO、
,達到平衡時,容器中NO、![]() 、
、![]() 的濃度之比為3:1:1,則Q____________
的濃度之比為3:1:1,則Q____________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是 ___________
在恒容條件下,能判斷該反應一定達到化學平衡狀態的依據是 ___________![]() 填選項編號
填選項編號![]() .
.
![]() 單位時間內生成
單位時間內生成![]() 的同時消耗
的同時消耗![]()
![]() 反應體系的溫度不再發生改變
反應體系的溫度不再發生改變
![]() 混合氣體的密度不再發生改變
混合氣體的密度不再發生改變
![]() 反應體系的壓強不再發生改變
反應體系的壓強不再發生改變
(3)鋁電池性能優越,![]() 電池可用作水下動力電源,其原理如圖所示:請寫出該電池正極反應式_____________________________________________;常溫下,用該化學電源和惰性電極電解300ml硫酸銅溶液(過量),消耗27mgAl,則電解后溶液的
電池可用作水下動力電源,其原理如圖所示:請寫出該電池正極反應式_____________________________________________;常溫下,用該化學電源和惰性電極電解300ml硫酸銅溶液(過量),消耗27mgAl,則電解后溶液的![]() ___________
___________![]() 不考慮溶液體積的變化
不考慮溶液體積的變化![]() 。
。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A. 鋁粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化鐵溶液中加入鐵粉![]()
D. FeCl2溶液跟Cl2反應:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于苯甲酸的分離、提純實驗,下列說法不正確的是
A. 苯甲酸在水中的溶解度隨溫度的升高變化很小
B. 趁熱過濾的目的是為了除去泥沙,并減少苯甲酸的損失
C. 趁熱過濾后將濾液降溫可以得到苯甲酸
D. 如果想進一步提純苯甲酸,可以再次配成熱飽和溶液,并降溫結晶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置或操作能達到實驗目的(必要的夾持裝置及石棉網已省略)的是

A. 實驗室制乙烯
B. 實驗室制乙炔并驗證乙炔能發生氧化反應
C. 實驗室中分餾石油
D. 若甲為硫酸,乙為貝殼(粉狀),丙為苯酚鈉溶液,驗證硫酸、碳酸、苯酚酸性的強弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應3H2+N22NH3 , 下列措施能使反應物中活化分子百分數、化學反應速率和化學平衡常數都變化的是( )
A.使用高效催化劑
B.充入更多N2
C.降低溫度
D.增大壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有鎂鋁銅合金1.2 g,加入過量的鹽酸中,在標準狀況下放出氫氣1.12 L,反應后過濾得沉淀0.2 g。若將此合金放入過量的燒堿溶液中,反應后,在標準狀況下,產生氫氣的體積約為多少?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。右圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連。請回答以下問題:
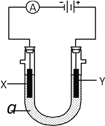
(1)若X、Y都是惰性電極,a是飽和NaCl溶液,實驗開始時,同時在兩邊各滴入幾滴酚酞試液,則
①在X極附近觀察到的現象是________________________。
②Y電極上的電極反應式為________________________,檢驗該電極反應產物的方法是_____________________________________。
(2)如要用電解方法精煉粗銅,電解液a選用CuSO4溶液,則
①X電極的材料是__________,電極反應式是_______________________________________。
②Y電極的材料是__________,電極反應式是_______________________________________。(說明:雜質發生的電極反應不必寫出)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com