
【題目】(1)①標準狀況下,1g氫氣和14g氮氣的體積相同
②常溫常壓下,16g氧氣和臭氧的混合氣體中含有的質子數為8NA
③0.1L 0.5mol/LCH3CH2OH溶液中含有氫原子數為0.3NA
④常溫常壓下,28gCO的體積大于22.4L
⑤分子總數相等的NO2和CO2,所含氧原子數均為2NA
上述表述中正確的有:_______
(2)用容量瓶配制溶液時,由于操作不當會引起誤差
①用天平稱量時所用砝碼生銹
②用量筒量取所需濃溶液時,仰視刻度
③溶液轉移到容量瓶后,燒杯及玻璃棒未用蒸餾水洗滌
④轉移溶液前容量瓶內有少量蒸餾水
⑤定容時,俯視容量瓶的刻度線
⑥定容后搖勻,發現液面降低,又補加少量水,重新達到刻度線
上述情況會使所配溶液濃度偏低的是 :_______
【答案】①②④ ③⑥
【解析】
⑴①標準狀況下,1g氫氣物質的量![]() ,14g氮氣的物質的量
,14g氮氣的物質的量![]() ,同溫同壓,體積之比等于物質的量之比,因此體積相同,故①正確;
,同溫同壓,體積之比等于物質的量之比,因此體積相同,故①正確;
②常溫常壓下,16g氧氣物質的量![]() ,一個氧氣含有質子數16個,0.5 mol氧氣含有質子數為0.5mol × 2 × NA mol-1 =8NA,16g臭氧物質的量
,一個氧氣含有質子數16個,0.5 mol氧氣含有質子數為0.5mol × 2 × NA mol-1 =8NA,16g臭氧物質的量![]() ,一個臭氧含有24個質子數,
,一個臭氧含有24個質子數,![]() 臭氧含有質子數為
臭氧含有質子數為![]() ×3×NA mol-1 = 8NA,因此16g混合氣體中含有的質子數為8NA,故②正確;
×3×NA mol-1 = 8NA,因此16g混合氣體中含有的質子數為8NA,故②正確;
③0.1L 0.5mol/LCH3CH2OH物質的量![]() ,含有氫原子數0.05mol × 6 × NA mol-1 =0.3NA,但由于溶液中有水,水中含有氫原子,因此含有氫原子數為大于0.3NA,故③錯誤;
,含有氫原子數0.05mol × 6 × NA mol-1 =0.3NA,但由于溶液中有水,水中含有氫原子,因此含有氫原子數為大于0.3NA,故③錯誤;
④常溫常壓下,28gCO的物質的量![]() ,常溫常壓下,氣體摩爾體積大于22.4Lmol-1,因此常溫常壓下28gCO的體積大于22.4L,故④正確;
,常溫常壓下,氣體摩爾體積大于22.4Lmol-1,因此常溫常壓下28gCO的體積大于22.4L,故④正確;
⑤分子總數相等的NO2和CO2,每個分子都含有2個原子,但物質的量不清楚,不能說所含氧原子數均為2NA,只能說所含的原子數相等,故⑤錯誤;所以上述表述中正確的有:①②④,故答案為①②④;
⑵①用天平稱量時所用砝碼生銹,砝碼質量增加,稱量物質質量增加,所配制溶液濃度偏高,因此①不符合題意;
②用量筒量取所需濃溶液時,仰視刻度,所得濃溶液體積偏大,配制后溶液誤差偏高,故②不符合題意;
③溶液轉移到容量瓶后,燒杯及玻璃棒未用蒸餾水洗滌,溶液中溶質少了,誤差偏低,故③符合題意;
④轉移溶液前容量瓶內有少量蒸餾水,有水時后面定容時少加水即可,因此不影響,故④不符合題意;
⑤定容時,俯視容量瓶的刻度線,溶液的體積偏小,誤差偏高,故⑤不符合題意;
⑥定容后搖勻,發現液面降低,又補加少量水,重新達到刻度線,溶液的體積偏大,誤差偏低,故⑥符合題意;因此會使所配溶液濃度偏低的是③⑥,故答案為③⑥。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】磷化鋁(AlP)是一種常用于糧食倉儲的廣譜性熏蒸殺蟲劑,遇水立即產生高毒性氣體 PH3(沸點-89.7℃,還原性強)。國家衛計委規定糧食中磷化物(以PH3計)的殘留量不超過0.0500 mg/kg時為質量合格,反之不合格。某化學興趣小組的同學用下述方法測定某糧食樣品 中殘留磷化物的質量以判斷是否合格。
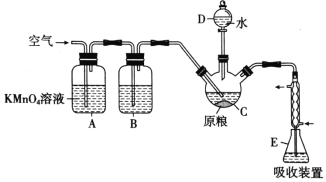
在C中加入100g原糧,E中加入20.00 mL 2.50×10-4 mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反應后,用亞硫酸鈉標準溶液滴定E中過量的KMnO4溶液。回答下列問題:
(1)PH3的電子式為___________。儀器C的名稱是___________。
(2)A中酸性高錳酸鉀溶液的作用是___________通入空氣的作用是______________________。
(3)PH3也可被NaClO氧化可用于制備NaH2PO2,制得的NaH2PO2和NiCl2溶液可用于化學鍍鎳, 同時生成磷酸和氯化物,請寫出化學鍍鎳的化學方程式為______________________________。
(4)裝置E中PH3被氧化成磷酸,充分反應后的吸收液,加水稀釋至250mL,取25.00mL于錐形瓶中,用4.0×10-5mol/L的Na2SO3標準溶液滴定剩余的KMnO4溶液,消耗Na2SO3標準溶液 20.00mL,Na2SO3與KMnO4溶液反應的離子方程式為:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),則滴定終點的現象為______________________________________________。
該原糧樣品中磷化物(以PH3計)的殘留量為__________________mg/kg。(保留三位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】KClO3和濃鹽酸在一定溫度下反應會生成黃綠色的易爆物二氧化氯。其變化可表述為:KClO3+HCl(濃)== KCl+ClO2↑+Cl2↑+。
(1)請 寫出完整的化學方程式并配平_______。
(2)濃鹽酸在反應中顯示出來的性質是_______(填寫編號)。
①只有還原性 ②還原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)用雙線橋法標明電子轉移的方向和數目____。
(4)產生0.1molCl2,則轉移的電子的物質的量為___mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室欲用NaOH固體配制1.0 mol·L-1的NaOH溶液240 mL,下列敘述不正確的是( )

A.某同學欲稱量一定量的NaOH固體,他先用托盤天平稱量燒杯的質量,天平平衡后的狀態如圖。則燒杯的實際質量為27.4 g
B.要完成本實驗該同學應稱出10.0g NaOH
C.氫氧化鈉固體溶解后必須恢復至室溫再進行轉移
D.容量瓶使用前需洗滌、并保持干燥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將露置于空氣中的某氫氧化鈉固體樣品溶于水,向所得溶液中逐滴加入稀鹽酸至過量,生成的CO2(標準狀況)與加入的鹽酸的體積有如圖所示的關系(不考慮CO2在水中的溶解)。下列說法不正確的是( )
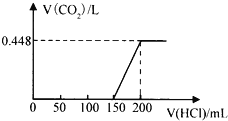
A. 滴加鹽酸0→150mL段發生的反應依次為OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用鹽酸的物質的量濃度為0.4 molL﹣1
C. CO2體積不再改變時,溶液中的溶質為NaCl
D. 該樣品中NaOH與Na2CO3物質的量之比為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業制得的氮化鋁(AlN)產品中常含有少量Al4C3、Al2O3、C等雜質。某同學設計如下實驗分別測定氮化鋁(AlN樣品中AlN和Al4C3的質量分數(忽略NH3在強堿性溶液中的溶解)。
(1)實驗原理:①Al4C3與硫酸反應可生成CH4;
②AlN溶于強酸產生銨鹽,溶于強堿生成氨氣,請寫出AlN與NaOH溶液反應的化學方程式:____________。
(2)實驗裝置(如圖所示,量氣管為堿式滴定管改裝)
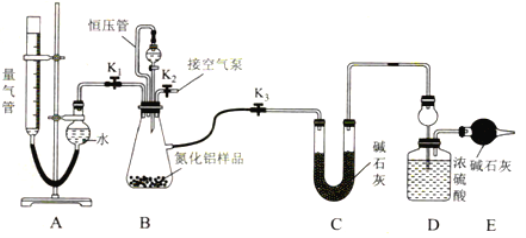
連好裝置后,首先應進行的操作是________。
(3)實驗過程:稱得裝置D的初始質量為y g;稱取x g AlN樣品置于裝置B錐形瓶中,各裝置中加入相應藥品,重新連好裝置;讀取量氣管的初始讀數為a mL(量氣裝置左右液面相平)。
①欲首先測量Al4C3質量分數的有關數據,對三個活塞的操作是________。
②若無恒壓管,對所測氣體體積的影響是________(填“偏大”“偏小”或“無影響”)
③量氣管中液面不再發生變化,說明反應已經結束。讀取讀數之前,應對量氣管進行調整量氣管高度,使左右兩邊液面相平 ,若量氣管中的液面高于右側球形容器中的液面,所測氣體的體積______(填“偏大”“偏小”或“無影響”)。
④記錄滴定管的讀數為b mL(已知:該實驗條件下的氣體摩爾體積為Vm L·mol-1),則Al4C3的質量分數為______(用含a、b、x、y、Vm的代數式表示)。
⑤測量AlN質量分數的數據:首先關閉活塞 K1 ,打開活塞K3,通過分液漏斗加入過量___,與裝置B瓶內物質充分反應;反應完成后,____(填入該步應進行的操作),最后稱得裝置D的質量為z g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 56g聚乙烯分子中含碳碳雙鍵的數目為2 NA
B. 2 mol NH3和3molO2在催化劑和加熱條件下充分反應生成NO的分子數為2 NA
C. 鉛蓄電池放電時負極凈增質量比正極凈增質量多16g時轉移電子數為NA
D. 1L0.5 mol/L Al2Fe(SO4)4溶液中陽離子數目小于1.5 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗所用試劑、現象和結論均正確的是
選項 | 實驗裝置 | 現象 | 結論 |
A |
| 裝置Ⅲ中有淺黃色沉淀 | 苯和濃溴水發生取代反應 |
B |
| 高錳酸鉀溶液褪色,溴的四氯化碳溶液褪色 | 石蠟油的分解產物中含有不飽和烴 |
C |
| 盛有飽和碳酸鈉溶液的試管中,上方出現油狀液體 | 制備乙酸乙酯 |
D |
| 甲醚有氣泡 | 鑒別乙醇與甲醚(CH3OCH3) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知可逆反應:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反應物起始物質的量相同,下列關于該反應的示意圖不正確的是( )
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反應物起始物質的量相同,下列關于該反應的示意圖不正確的是( )
A.  B.
B. 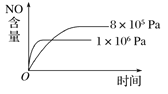
C. 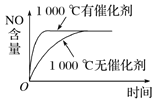 D.
D. 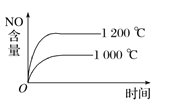
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com