
【題目】下列說法正確的是( )
A.將濃度為0.1 mol?L﹣1HF溶液加水不斷稀釋過程中,c(H+)和c(OH﹣)都會減小
B.25℃時,等體積、等pH的HCl、H2SO4、CH3COOH溶液分別與足量鋅粉反應,H2SO4溶液產生的H2量最多
C.Na2CO3溶液存在水解平衡:CO ![]() +H2O?HCO
+H2O?HCO ![]() +OH﹣ , 加入NaOH固體會使平衡逆向移動,溶液pH減小
+OH﹣ , 加入NaOH固體會使平衡逆向移動,溶液pH減小
D.25℃時,pH均為8的CH3COONa和NaOH溶液中,由水電解產生的c(OH﹣)之比為100:1
【答案】D
【解析】解:A、一定溫度下的溶液中存在離子積常數,氫氧根離子濃度和氫離子濃度乘積為常數,將濃度為0.1molL﹣1 HF溶液加水不斷稀釋過程中,c(H+)會減小,c( OH﹣)離子濃度增大,故A錯誤;B、CH3COOH為弱酸,等pH時,CH3COOH濃度最大,則醋酸放出的氫氣最多,故B錯誤;
C、Na2CO3溶液存在水解平衡:CO32﹣+H2OHCO ![]() +OH﹣ , 加入NaOH固體會使平衡逆向移動,但pH值變大,故C錯誤;
+OH﹣ , 加入NaOH固體會使平衡逆向移動,但pH值變大,故C錯誤;
D、酸或堿抑制水電離,含有弱離子的鹽促進水電離,NaOH溶液中c(H+)等于水電離出c(OH﹣)=10﹣8 mol/L,CH3COONa溶液 ![]() mol/L=10﹣6 mol/L,兩溶液中由水電離出的c(OH﹣)之比=
mol/L=10﹣6 mol/L,兩溶液中由水電離出的c(OH﹣)之比= ![]() =1:100,故D正確;
=1:100,故D正確;
故選D.
【考點精析】通過靈活運用弱電解質在水溶液中的電離平衡,掌握當弱電解質分子離解成離子的速率等于結合成分子的速率時,弱電解質的電離就處于電離平衡狀態;電離平衡是化學平衡的一種,同樣具有化學平衡的特征.條件改變時平衡移動的規律符合勒沙特列原理即可以解答此題.


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:
【題目】亞硝酰氯(NOCl)是有機合成中的重要試劑,可由NO與Cl2在常溫常壓下合成。已知NOCl是一種紅褐色液體或黃色氣體,其熔點64.5℃,沸點5.5℃,遇水易水解。
(1)實驗室制備原料氣NO和Cl2的裝置如下圖所示: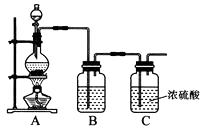
①實驗室制NO時,裝置A中燒瓶內發生反應的化學方程式為。
②實驗室制Cl2時,裝置B中盛放的試劑為 , 其作用是。
(2)將上述收集到的Cl2充入集氣瓶中,按圖示裝置制備亞硝酰氯。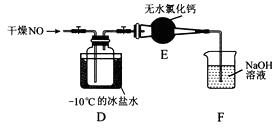
①NOCl分子中各原子均滿足8電子穩定結構,則NOCl的電子式為。
②裝置D中的現象為。
③裝置E中無水氯化鈣的作用為。
④某同學認為裝置F不能吸收NO,為解決這一問題,可將尾氣與某種氣體同時通入氫氧化鈉溶液中,這種氣體的化學式是。
(3)NO可用間接電化學法除去,其原理如下圖所示:
①陰極的電極反應式為。
②吸收塔內發生反應的離子方程式為。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關敘述正確的是
A. 電泳現象可證明膠體帶電荷
B. 直徑在1~100nm之間的粒子稱為膠體
C. 是否具有丁達爾效應是區分溶液、膠體和濁液的依據
D. 膠體粒子很小,可以透過濾紙
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知NO2和N2O4可以相互轉化:2NO2(g)N2O4(g)△H<0.在恒溫條件下將一定量NO2和N2O4的混合氣體通入一容積為2L的密閉容器中,反應物濃度隨時間變化關系如圖.下列說法不正確的是( ) 
A.圖中的兩條曲線,X表示NO2濃度隨時間的變化曲線
B.前10 min內用v(N2O4)=0.02 mol/(Lmin)
C.25 min時,NO2轉變為N2O4的反應速率增大,其原 因是將密閉容器的體積縮小為1L
D.該溫度下反應的平衡常數 K=1.11 L/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】危險化學品的外包裝上常印有警示性標志。下列化學藥品名稱與警示性標志名稱對應不正確的是
A. 酒精——劇毒品B. 硝酸銨——爆炸品
C. 汽油——易燃品D. 苛性鈉——腐蝕品
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述中,正確的是( )
A.常溫下鋁和濃硫酸、濃硝酸不反應
B.兩份相同質量的鋁粉,分別與足量的稀硫酸和氫氧化鈉溶液反應,產生的氫氣前者多
C.合金的熔點一般比組成它的各成分的熔點都高
D.工業上常利用鋁熱反應冶煉難熔的金屬,如釩
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三草酸合鐵酸鉀晶體K3[Fe(C2O4)3]3H2O可用于攝影和藍色印刷.某小組將無水三草酸合鐵酸鉀在一定條件下加熱分解,對所得氣體產物和固體產物進行實驗和探究.該小組同學查閱資料知,固體產物中鐵元素不可能以三價形式存在,而鹽只有K2CO3 , 產生的氣體中含有CO、CO2 . 請利用實驗室常用儀器、用品和以下限選試劑完成驗證和探究過程.
限選試劑:①蒸餾水 ②3%H2O2溶液 ③氧化銅 ④1.0 molL﹣1鹽酸⑤濃硫酸⑥1.0 molL﹣1NaOH溶液 ⑦澄清石灰水 ⑧0.5 molL﹣1 CuSO4溶液 ⑨2%KSCN溶液 ⑩苯酚溶液
(1)若用一套連續實驗裝置檢驗氣體產物中CO的存在,并驗證檢驗過程中有CO2生成,應選用的試劑為(按先后順序把所選試劑的標號填入空格內)
(2)提出合理假設假設1:只有Fe; 假設2:只有FeO; 假設3: .
(3)設計實驗方案并實驗驗證步驟1:取適量固體產物于試管中,加入足量蒸餾水溶解,過濾分離出不溶固體.
步驟2:取少量上述不溶固體放入試管中,加入足量溶液,充分振蕩.若固體無明顯變化,則假設成立;若有暗紅色固體生成,則反應的離子方程式為 .
步驟3:取步驟2所得暗紅色固體于試管中,滴加過量 , 振蕩后靜置.若溶液基本無色,則假設成立;若溶液呈 , 則假設3成立.
(4)問題討論若固體產物中FeO含量較少,用步驟3方法難以確定.請你設計實驗方案證明假設3成立(寫出實驗的操作步驟、現象與結論): .
(5)拓展與延伸有資料介紹“在含Fe2+的溶液中,先滴加少量新制飽和氯水,然后滴加KSCN溶液,溶液呈紅色;若再滴加過量氯水,卻發現紅色褪去”.假設溶液中的+3價鐵還能被氯水氧化為更高價的QUOTE,試寫出該反應的離子方程式 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,反應2SO2+O2 ![]() 2SO3 , 達到平衡時,n(SO2):n(O2):n(SO3)=2:3:4.縮小體積,反應再次達到平衡時,n(O2)=0.8mol,n(SO3)=1.4mol,此時SO2的物質的量應是( )
2SO3 , 達到平衡時,n(SO2):n(O2):n(SO3)=2:3:4.縮小體積,反應再次達到平衡時,n(O2)=0.8mol,n(SO3)=1.4mol,此時SO2的物質的量應是( )
A.0.6 mol
B.0.4 mol
C.0.8 mol
D.1.2 mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com