
工業上常利用低品位軟錳礦漿(主要成分是MnO2)來吸收含SO2的廢氣,最終制得硫酸錳晶體(MnSO4·H2O),其主要流程如下: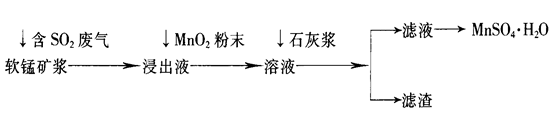
已知:浸出液的pH<2,其中的金屬離子主要是Mn2+,還含有少量的Fe2+、Al3+等其他金屬離子。有關金屬離子形成氫氧化物沉淀時溶液的pH見下表:
| 離子 | 開始沉淀時的pH | 完全沉淀時的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(12分,每空2分)(1)SO2+MnO2=MnSO4
(2)將Fe2+氧化為Fe3+;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
(3)使Fe3+、Al3+完全沉淀;4.7≤pH<8.3 (4)Fe(OH)3、Al(OH)3、CaSO4
解析試題分析:(1)低品位軟錳礦漿的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金屬離子主要是Mn2+,這說明MnO2與SO2發生了氧化還原反應,反應的化學方程式為SO2+MnO2=MnSO4。
(2)雜質離子中Fe2+完全沉淀時的pH大于Mn2+開始沉淀時的pH,所以必須利用其還原性將其氧化成鐵離子而除去。由于MnO2具有氧化性,能把亞鐵離子氧化生成Fe3+,有關反應的離子方程式為2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
(3)溶液的雜質離子Fe3+、Al3+陽離子,從圖可表以看出,大于4.7可以將Fe3+和Al3+除去,但不能超過8.3,以防止Mn2+也沉淀,所以只要調節pH值在4.7≤pH<8.3間即可。
(4)Fe3+、Al3+等金屬陽離子通過調pH值,轉化為氫氧化鐵、氫氧化鋁沉淀,同時還生成微溶性的硫酸鈣,所以濾渣主要有氫氧化鐵、氫氧化鋁、硫酸鈣,其化學式分別是Fe(OH)3、Al(OH)3、CaSO4。
考點:考查氧化還原反應方程式的書寫、物質的除雜、反應條件的控制以及生成物的判斷等


科目:高中化學 來源: 題型:填空題
鉻鐵礦的主要成分可表示為FeO·Cr2O3,還含有MgO、Al2O3、Fe2O3等雜質,以下是以鉻鐵礦為原料制備重鉻酸鉀(K2Cr2O7)的流程圖: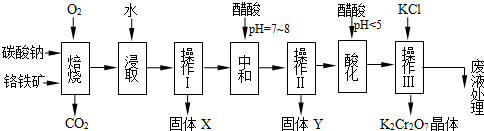
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2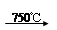 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3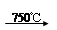 2NaAlO2 + CO2↑;③ Cr2O72-+ H2O
2NaAlO2 + CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
(1)固體X中主要含有_________(填寫化學式);要檢測酸化操作中溶液的pH是否等于4.5,應該使用__________(填寫儀器或試劑名稱)。
(2)酸化步驟用醋酸調節溶液pH<5,其目的是_________________________________。
| 物質 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
 ), 該反應可用來檢驗Cr2O72-的存在。寫出反應的離子方程式: 。
), 該反應可用來檢驗Cr2O72-的存在。寫出反應的離子方程式: 。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
海水中含有豐富的鎂資源。工業上常用海水曬鹽后的苦鹵水提取Mg,流程如下圖所示: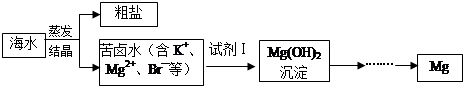
(1)工業制取鎂的方法是 法。
(2)試劑Ⅰ一般選用 (填化學式)。
(3)下圖是金屬鎂和鹵素反應的能量變化圖(反應物和產物均為298K時的穩定狀態)。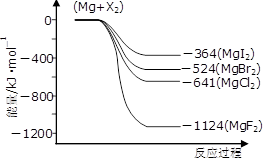
①由圖可知Mg與鹵素單質的反應均為 (填“放熱”或“吸熱”)反應;推測化合物的熱穩定性順序為MgI2 MgF2(填“>”、“=”或“<”)。
②依上圖數據寫出MgBr2(s)與Cl2(g)反應的熱化學方程式 。
(4)金屬Mg與CH3Cl在一定條件下反應可生成CH3MgCl,CH3MgCl是一種重要的有機合成試劑,易與水發生水解反應并有無色無味氣體生成。寫出CH3MgCl水解的化學方程式 。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,請結合平衡原理和必要的文字解釋原因 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
銀銅合金廣泛用于航空工業。從切割廢料中回收銀并制備銅化工產品的工藝如下圖:
(1)電解精練銀時,陰極反應式為_______________;濾渣A與稀HNO3反應,產生的氣體在空氣中迅速變為紅棕色,該紅棕色氣體與水反應的化學方程式為_______________________________________。
(2)固體混合物B的組成為_____________;在生成固體B的過程中,必須控制NaOH的加入量,若NaOH過量,則因過量引起的反應的離子方程式為_____________________。
(3)煅燒過程中生成的氧化產物與NH3在催化劑條件下反應的化學方程式為_____________________。這個反應中會有白煙產生,該白煙為______________。
(4)若銀銅合金中銅的質量分數為64%,理論上3.0kg廢料中的銅可完全轉化為__________molCuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液___________L。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
工業上用粉碎的煤矸石(主要含Al2O3、SiO2及鐵的氧化物)制備凈水劑BAC〔Al2(OH)nCl6-n〕的流程如下: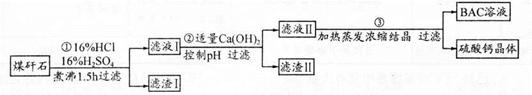
(1)粉碎煤矸石的目的是______;濾渣I的主要成分是______ (填化學式)。
(2)步驟①在煮沸的過程中,溶液逐漸由無色變為綠色,此時溶液中有色離子為______(填化學式);隨后溶液又變為棕黃色,相關離子反應方程式為______;
步驟①的煮沸裝置上方需安裝一長導管,長導管的作用是____________。
(3)步驟②中加入適量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________;巳知BAC的分散質粒子大小在1 nm?100 nm之間,由此區別濾液I與BAC兩種液體的物理方法是______;若Ca(OH)2溶液過量,則步驟③得到的BAC產率偏低,寫出該反應的離子方程式______。
(4)若0.1 molAlCl3在某溫度下溶于蒸餾水,當有5℅水解生成Al(OH)3溶液時,吸收熱量a kJ。寫出該過程的熱化學方程式____________。
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
(16分)某同學從網絡上了解到菠菜中富含可溶性的兩類正鹽:草酸鹽和碳酸鹽。該同學欲用實驗驗證這一事實并檢測其中草酸鹽的含量。查閱資料得知草酸(H2C2O4)是一種二元有機弱酸,具有較強的還原性;草酸鈣(CaC2O4)不溶于水能溶于稀硫酸。請回答下列問題:
(1)該學生將菠菜研磨成粉末、熱水浸泡、過濾得到澄清溶液A。研磨菠菜使用的實驗儀器的名稱為 。
(2)設計實驗方案驗證菠菜中含有草酸鹽和碳酸鹽,補充完成預期現象和結論。
| 實驗步驟 | 預期現象和結論 |
| 步驟1:調節溶液A至弱堿性,滴加足量CaCl2溶液。 | ①出現白色沉淀,說明菠菜中 。 |
| 步驟2:取步驟1的沉淀于試管中,加入足量的稀硫酸,沉淀完全溶解,并將產生的無色無味的氣體通入澄清石灰水中。 | ② 。 |
| 步驟3:向步驟2得到的溶液中滴加幾滴高錳酸鉀溶液。 | ③ 。 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(12分)1,2 -二溴乙烷可作汽油抗爆劑的添加劑,常溫下它是無色液體,密度2.18 g·cm-3,沸點131.4℃,熔點9.79℃,不溶于水,易溶于醇、醚、丙酮等有機溶劑。在實驗室中可以用下圖所示裝置制備1,2 -二溴乙烷。其中分液漏斗和燒瓶a中裝有乙醇和濃硫酸的混合液,試管d中裝有液溴(表面覆蓋少量水)。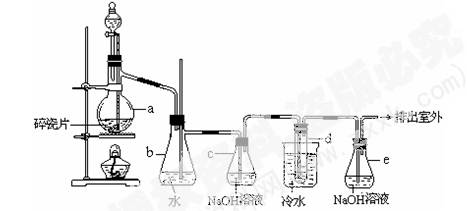
填寫下列空白:
(1)寫出本題中制備1,2-二溴乙烷的兩個化學反應方程式。_ ;_____________________。
(2)安全瓶b可以防止倒吸,并可以檢查實驗進行時試管d是否發生堵塞。請寫出發生堵塞時瓶b中的現象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某學生在做此實驗時,使用一定量的液溴,當溴全部褪色時,所消耗乙醇和濃硫酸混合液的量,比正常情況下超過許多。如果裝置的氣密性沒有問題,試分析其可能的原因: ______________, _____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(12分)氯化鉀樣品中含有少碳酸鉀、硫酸鉀和不溶于水的雜質。為了提純氯化鉀,先將樣品溶于適量水中,充分攪拌后過濾,再將過濾液按下圖所示步驟進行操作。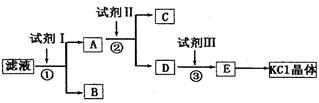
回答下列問題:
(1)起始時濾液的pH_____7(填“大于”“小于”或“等于”),其原因是__________________(用離子方程式表示)。
(2)試劑I的化學式為______,①中發生反應的離子方程式為_____________________。
(3)試劑II的化學式為_____,②中加入試劑II的目的是_________________________。
(4)試劑III的名稱是_____,③中發生反應的離子方程式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
已知木炭在一定條件下與濃硝酸反應生成兩種+4價的氧化物,為了探究一氧化氮(NO)能否與過氧化鈉反應,以及反應后的產物中是否有亞硝酸鈉(NaNO2),某小組同學設計了如圖所示裝置(夾持儀器和連接用的膠管已經省略)。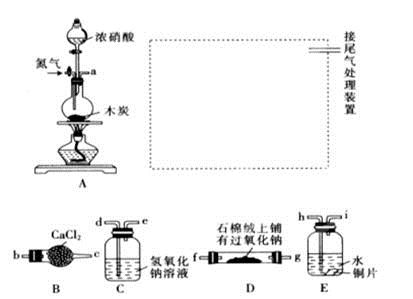
(1)為了完成該實驗,虛線框內還需要連接B~E四套裝置,按氣流方向連接的順序為:
a→( )( )→( )( )→( )( )→ ( )( )(填儀器接口的字母編號)。連接好儀器,檢查氣密性,裝入藥品后,要通入一段時間的氮氣,再滴加濃硝酸,點燃酒精燈,通入氮氣的主要目的是 。
(2)裝置E中觀察到的主要實驗現象有 。
(3)裝置C的作用是 。
(4)某同學經查閱資料后發現亞硝酸是弱酸,性質不穩定,室溫下易分解生成一氧化氮。裝置D中充分反應后,設計實驗證明D中是否有亞硝酸鈉生成: 。(寫出檢驗步驟及現象)。
(5)亞硝酸鈉在酸性條件下可將I-氧化為I2,同時生成NO,該反應常用于亞硝酸鈉含量的測定,請寫出該反應的離子方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com