
【題目】我國科學家設計了一種智能雙模式海水電池,滿足水下航行器對高功率和長續航的需求。負極為Zn,正極放電原理如圖。下列說法錯誤的是( )
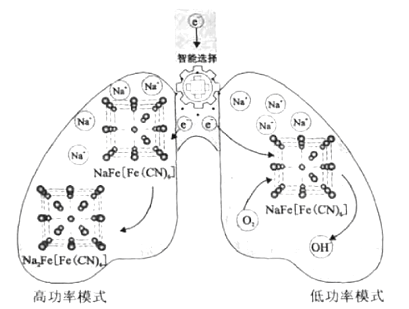
A. 電池以低功率模式工作時,NaFe[Fe(CN)6]作催化劑
B. 電池以低功率模式工作時,Na+的嵌入與脫嵌同時進行
C. 電池以高功率模式工作時,正極反應式為:NaFe[Fe(CN)6]+e-+Na+=Na2Fe[Fe(CN)6]
D. 若在無溶解氧的海水中,該電池仍能實現長續航的需求
【答案】D
【解析】
A.根據圖示可知:電池以低功率模式工作時,負極是Zn-2e-=Zn2+,正極上是NaFe[Fe(CN)6]獲得電子,然后與吸附在它上面的氧氣即溶液中發生反應為O2+4e-+2H2O=4OH-,從NaFe[Fe(CN)6]上析出,故NaFe[Fe(CN)6]的作用是作催化劑,A正確;
B.電池以低功率模式工作時,電子進入NaFe[Fe(CN)6]時Na+的嵌入;當形成OH-從NaFe[Fe(CN)6]析出時,Na+從NaFe[Fe(CN)6]脫嵌,因此Na+的嵌入與脫嵌同時進行,B正確;
C.根據電池以高功率模式工作時,正極上NaFe[Fe(CN)6]獲得電子被還原變為Na2Fe[Fe(CN)6],所以正極的電極反應式為:NaFe[Fe(CN)6]+e-+Na+=Na2Fe[Fe(CN)6],C正確;
D.若在無溶解氧的海水中,由于在低功率模式工作時需要氧氣參與反應,因此在該電池不能實現長續航的需求,D錯誤;
故合理選項是D。


科目:高中化學 來源: 題型:
【題目】已知常溫下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列說法中正確的是
A.含有大量Cl-的溶液中肯定不存在Ag+
B.AgI懸濁液中加入少量KI粉末,平衡AgI(s)![]() Ag+(aq)+I-(aq)向左移動,溶液中離子的總濃度會減小
Ag+(aq)+I-(aq)向左移動,溶液中離子的總濃度會減小
C.AgCl懸濁液中逐漸加入KI固體至c(I-)=Ksp(AgI)/Ksp(AgCl)mol·L-1時,AgCl開始向AgI沉淀轉化
D.向濃度均為0.01 mol·L-1的KCl和KI的混合溶液中滴加AgNO3溶液,當Cl-開始沉淀時,溶液中I-的濃度為1.25×10-8 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】莽草酸合成治療禽流感的藥物—達菲(Tamiflu)的原料之一。莽草酸是A的一種異構體。A的結構簡式如下:
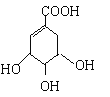 (提示:環丁烷
(提示:環丁烷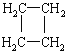 可簡寫成
可簡寫成![]() )
)
(1)A的分子式是_______________________________
(2)A與溴的四氯化碳溶液反應的化學方程式(有機物用結構簡式表示)_______________________
(3)A與乙醇反應的化學方程式(有機物用結構簡式表示)是_______________________
(4)17.4g A與足量碳酸氫鈉溶液反應,計算生成二氧化碳的體積(標準狀況)________________
(5)A在濃硫酸作用下加熱可得到B(B的結構簡式為![]() ),其反應類型是_______________。
),其反應類型是_______________。
(6)苯與硝酸反應生成硝基苯的方程式_______________________
(7)蔗糖水解的方程式______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖兩種化合物的結構或性質描述正確的是
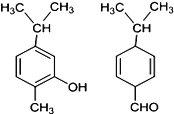
A. 兩種化合物均是芳香烴
B. 兩種化合物可用紅外光譜區分,但不能用核磁共振氫譜區分
C. 兩種化合物分子中共平面的碳原子數相同
D. 兩種化合物互為同分異構體,均能與溴水反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電-Fenton法是用于水體中有機污染物降解的高級氧化技術,其反應原理如圖所示。其中電解產生的H2O2與Fe2+發生Fenton反應:H2O2+Fe2+=Fe3++OH-+·OH,生成的羥基自由基(·OH)能氧化降解有機污染物。下列說法中正確的是

A.電源的X極為正極,Y極為負極
B.陰極的電極反應式為Fe2+-e-=Fe3+
C.陽極的電極反應式為H2O-e-=H++·OH
D.每消耗1molO2,整個電解池中理論上可產生2mol·OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知制備膠體的反應原理為: FeCl3+3H2O![]() Fe(OH)3(膠體)+3HCl,現有甲、乙、丙三名同學分別進行制備Fe(OH)3膠體的實驗
Fe(OH)3(膠體)+3HCl,現有甲、乙、丙三名同學分別進行制備Fe(OH)3膠體的實驗
Ⅰ、甲同學直接加熱飽和FeCl3溶液;
Ⅱ、乙同學向25 mL沸水中逐滴加入FeCl3飽和溶液;煮沸至液體呈紅褐色,停止加熱
Ⅲ、丙同學和乙同學一樣,但是溶液出現紅褐色后忘記停止,繼續加熱較長時間。
試回答下列問題:
(1)判斷膠體制備是否成功,可利用膠體的__________________________,其中操作方法及現象是_____________________________________。
(2)Fe(OH)3膠體是不是電解質:_______________(填“是”或“不是”)。
(3)丁同學檢查實驗結果發現___________(填甲、乙或丙)的燒杯底部有沉淀。
(4)丁同學利用所制得的Fe(OH)3膠體進行下列實驗:
①取部分膠體將其裝入U形管內,用石墨作電極,接通直流電,通電一段時間后發現陰極附近的顏色逐漸變深,這表明Fe(OH)3膠體的膠粒帶___________電荷。
②取部分膠體向其中逐滴滴加硫酸溶液,開始產生紅褐色沉淀,這是因為_________;繼續滴加,沉淀減少最終消失,寫出化學反應方程式__________________。
③欲除去Fe(OH)3膠體中混有的NaCl溶液的操作名稱是__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 1mol/LAlCl3溶液中,含![]() 數目小于
數目小于![]()
B. 25℃,![]() pH=1的稀硫酸中含有的
pH=1的稀硫酸中含有的![]() 數為
數為![]()
C. 標準狀況下,![]()
![]() 和
和![]() 混合氣體中含
混合氣體中含![]() 個原子
個原子
D. 由![]()
![]() 和少量
和少量![]() 形成的中性溶液中,CH3COO-數目為
形成的中性溶液中,CH3COO-數目為![]() 個
個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用兩支惰性電極插入50mLAgNO3溶液中,通電電解。當電解液的PH值從6.0變為3.0時(設電解時陰極沒有氫氣析出,且電解液在電解前后體積變化可以忽略),電極上析出銀的質量大約是:
A. 27mg B. 54mg C. 108mg D. 216mg
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物I是一種抗腦缺血藥物,合成路線如下:
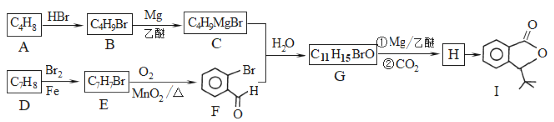
已知:
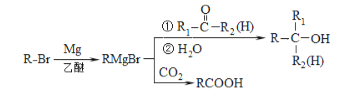
回答下列問題:
(1)按照系統命名法,A的名稱是_____;寫出A發生加聚反應的化學方程式:__________。
(2)反應H→I的化學方程式為________;反應E→F的反應類型是______。
(3)寫出符合下列條件的G的所有同分異構體的結構簡式:________
①遇FeCl3溶液發生顯色反應 ②核磁共振氫譜有4組峰
(4)α,α-二甲基芐醇(![]() )是合成醫藥、農藥的中間體,以苯和2-氯丙烷為起始原料制備α,α-二甲基芐醇的合成路線如下:
)是合成醫藥、農藥的中間體,以苯和2-氯丙烷為起始原料制備α,α-二甲基芐醇的合成路線如下:

該合成路線中X的結構簡式為____,Y的結構簡式為________;試劑與條件2為______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com