
(17分)金屬鎳具有優良的物理和化學特性,是高技術產業的重要原料。
(1)羰基法提純鎳涉及的反應為:Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
①當溫度升高時,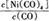 減小,則?H 0(填“>”或“<”)。
減小,則?H 0(填“>”或“<”)。
②一定溫度下,將一定量的粗鎳和CO加入一恒壓密閉容器中,下列示意圖正確且能說明反應達到平衡狀態的是________(填代號)。
若在相同溫度下,上述反應改在體積為1L的恒容密閉容器中進行,平衡常數 (填“增大”、“不變”或“減小”),反應進行3s后測得Ni(CO)4的物質的量為0.6mol,則0—3s內的平均反應速率v(CO)=____mol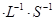 。
。
③要提高上述反應中CO的轉化率,同時增大反應速率,可采取的措施為____________________(寫出一條措施即可)。
(2)以NiS04溶液為電解質溶液進行粗鎳(含Fe、Zn、Cu、Pt、Au等雜質)的電解精煉,下列說法正確的是____________(填代號)。(已知氧化性: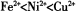 )
)
a.電解過程中,化學能轉化為電能
b.粗鎳作陽極,發生還原反應
c.利用陽極泥可回收Cu、Pt、Au等金屬
d.粗鎳精煉時通過的電量與陰極析出鎳的質量成正比
(3)工業上用硫化鎳(NiS)作為電極材料冶煉鎳。電解時,硫化鎳中的硫元素以單質形態沉積在某電極附近,鎳元素以Ni2+形態進入電解液中,如圖所示。硫化鎳與電源的____________(填“正極”或“負極”)相接。寫出陽極的電極反應式________________。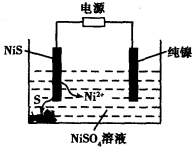
(1)①<;②bd;不變;0.8mol﹒L—1﹒S—1。③增大CO的濃度或增大壓強。(2)cd;
(3) 正極;NiS—2e- Ni2++S。
Ni2++S。
解析試題分析:(1)①對于反應:Ni(s)+4CO(g) Ni(CO)4(g),當溫度升高時,
Ni(CO)4(g),當溫度升高時,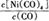 減小,說明平衡逆向移動,升高溫度平衡向吸熱反應方向移動,則該反應的逆向吸熱,正向為放熱反應,?H<0;②一定溫度下,將一定量的粗鎳和CO加入一恒壓密閉容器中,a.隨著反應的進行,容器內氣體的質量增大,物質的量減小,等壓條件下容器體積減小,密度逐漸增大,達平衡時密度不變,與圖像不符,錯誤;b.隨著反應的減小,反應物的濃度逐漸減小,正反應速率逐漸減小,達平衡時正反應速率不變,與圖像符合,正確;c.?H不隨反應的進行而變化,不能作為平衡標志,錯誤;d.CO的轉化率隨反應的進行不斷增大,達平衡時CO的轉化率不變,與圖像相符,正確,選bd;若在相同溫度下,上述反應改在體積為1L的恒容密閉容器中進行,影響平衡常數的外界因素為溫度,溫度不變,平衡常數不變;根據公式v=△n/V△t將題給數據代入計算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,則0—3s內的平均反應速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反應中CO的轉化率,同時增大反應速率,可采取的措施為增大CO的濃度或增大壓強。(2)遷移教材知識銅的電解精煉作答。以NiSO4溶液為電解質溶液進行粗鎳(含Fe、Zn、Cu、Pt、Au等雜質)的電解精煉, a.電解過程中,電能轉化為化學能,錯誤;b.粗鎳作陽極,發生氧化反應,錯誤;c.精煉過程中比鎳活潑的金屬Fe、Zn以離子形式進入電解質溶液,活潑性比鎳弱的金屬Cu、Pt、Au進入陽極泥,正確;d.粗鎳精煉時通過的電量與陰極析出鎳的質量成正比,正確,選cd;(3) 根據題意知,電解時,硫化鎳中的硫元素以單質形態沉積在某電極附近,硫元素的化合價由—2價升高為0價,發生氧化反應,作電解池的陽極,與電源的正極相接。陽極的電極反應式為NiS—2e-
減小,說明平衡逆向移動,升高溫度平衡向吸熱反應方向移動,則該反應的逆向吸熱,正向為放熱反應,?H<0;②一定溫度下,將一定量的粗鎳和CO加入一恒壓密閉容器中,a.隨著反應的進行,容器內氣體的質量增大,物質的量減小,等壓條件下容器體積減小,密度逐漸增大,達平衡時密度不變,與圖像不符,錯誤;b.隨著反應的減小,反應物的濃度逐漸減小,正反應速率逐漸減小,達平衡時正反應速率不變,與圖像符合,正確;c.?H不隨反應的進行而變化,不能作為平衡標志,錯誤;d.CO的轉化率隨反應的進行不斷增大,達平衡時CO的轉化率不變,與圖像相符,正確,選bd;若在相同溫度下,上述反應改在體積為1L的恒容密閉容器中進行,影響平衡常數的外界因素為溫度,溫度不變,平衡常數不變;根據公式v=△n/V△t將題給數據代入計算得v(Ni(CO)4)=0.2mol﹒L—1﹒S—1,則0—3s內的平均反應速率v(CO)=0.8mol﹒L—1﹒S—1。③要提高上述反應中CO的轉化率,同時增大反應速率,可采取的措施為增大CO的濃度或增大壓強。(2)遷移教材知識銅的電解精煉作答。以NiSO4溶液為電解質溶液進行粗鎳(含Fe、Zn、Cu、Pt、Au等雜質)的電解精煉, a.電解過程中,電能轉化為化學能,錯誤;b.粗鎳作陽極,發生氧化反應,錯誤;c.精煉過程中比鎳活潑的金屬Fe、Zn以離子形式進入電解質溶液,活潑性比鎳弱的金屬Cu、Pt、Au進入陽極泥,正確;d.粗鎳精煉時通過的電量與陰極析出鎳的質量成正比,正確,選cd;(3) 根據題意知,電解時,硫化鎳中的硫元素以單質形態沉積在某電極附近,硫元素的化合價由—2價升高為0價,發生氧化反應,作電解池的陽極,與電源的正極相接。陽極的電極反應式為NiS—2e- Ni2++S。
Ni2++S。
考點:考查化學反應速率、化學平衡的影響因素及計算,電解原理的應用及電極反應式的書寫。


科目:高中化學 來源: 題型:填空題
(8分)水煤氣不僅是合成氨的原料氣也是合成烴及其化工產品的原料。
(1)直接水煤氣燃料電池中,通CO、H2的極為電池的 極(選填:“正”,“負”)。
(2)水煤氣變換反應:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反應速率的有 (不定項選擇)。
CO2(g) + H2(g) △H < 0,下列措施能提高反應速率的有 (不定項選擇)。
a.升高溫度 b.加入催化劑 c.增大壓強 d.降低濃度
(3)H2和N2在催化劑、高溫高壓條件下合成氨的化學方程式為 。
(4)氨氣的水溶液可用于吸收煙道氣中的二氧化硫,該反應的化學方程式為 。
(5)將標準狀況下582.4L合成氣(已知:n(CO)∶n(H2)=4∶9)通入合成塔,一定條件下可發生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反應后,經測定產品中只有甲烷、乙烯和水蒸氣(假定CO和H2均無剩余),試計算逸出的氣體中乙烯的物質的量(列出計算過程)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(9分)硝基苯甲酸乙酯在OH-存在下發生水解反應:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH.兩種反應物的初始濃度均為0.050mol/L,15 ℃時測得:O2NC6H4COOC2H5的轉化率α隨時間變化的數據如表所示。回答下列問題:
O2NC6H4COO-+C2H5OH.兩種反應物的初始濃度均為0.050mol/L,15 ℃時測得:O2NC6H4COOC2H5的轉化率α隨時間變化的數據如表所示。回答下列問題:
| t/s | 0 | 120 | 180 | 240 | 330 | 30 | 600 | 700 | 800 |
| α/% | 0 | 33.0 | 41.8 | 48.8 | 58.0 | 69.0 | 70.4 | 71.0 | 71.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(7分)(1)某溫度下,2L恒容密閉容器中,X、Y、Z三種氣體發生化學反應時,物質的量隨時間變化的關系曲線如圖所示,則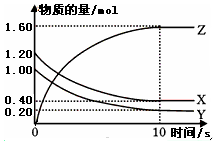
①此反應的化學方程式為________________;
②0~10s內,用Z表示的化學反應速率為________________;
③X的轉化率為________________;
(2)恒溫恒容時,某密閉容器中發生反應:C(s)+CO2(g) 2CO(g),下列描述中能說明該反應已達到化學平衡狀態的是________________。
2CO(g),下列描述中能說明該反應已達到化學平衡狀態的是________________。
①C(s)的濃度不再改變 ②CO2的體積分數不再改變
③氣體的質量不再改變 ④氣體的密度不再改變
⑤單位時間內消耗1molCO2,同時生成2molCO
⑥n(CO2):n(CO)=1:2 ⑦v正(CO2)=2v逆(CO)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)已知化學平衡、電離平衡、水解平衡和溶解平衡均符合勒夏特列原理。請回答下列問題:
(1)可逆反應FeO(s)+CO(g) Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如下表:
Fe(s)+CO2(g)是煉鐵工業中一個重要反應,其溫度與平衡常數K的關系如下表:
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分)在一定條件下,二氧化硫和氧氣發生如下反應:
2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)寫出該反應的化學平衡常數表達式K=__________。
(2)降低溫度,該反應K值______,二氧化硫轉化率______,化學反應速率______。(以上均填“增大”“減小”或“不變”)
(3)600 ℃時,在一密閉容器中,將二氧化硫和氧氣混合,反應過程中SO2、O2、SO3物質的量變化如圖所示,反應處于平衡狀態的時間是________。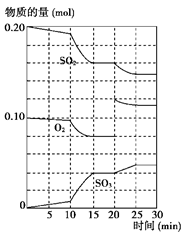
(4)據上圖判斷,反應進行至20 min時,曲線發生變化的原因是________________ _(用文字表達);10 min到15 min的曲線變化的原因可能是________(填寫編號)。
| A.加了催化劑 | B.縮小容器體積 | C.降低溫度 | D.增加SO3的物質的量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)氮的化合物是中學化學的重要物質,與人類生活密切相關。
(1)金屬與不同密度的硝酸溶液反應所得的還原產物比較復雜,如圖所示: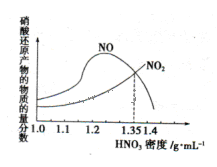
請寫出鐵與密度為1.35 g.m 的硝酸反應的化學方程式:______________________.
的硝酸反應的化學方程式:______________________.
(2)亞硝酸鈉是一種致癌物質,它在中性或堿性條件下是穩定的,酸化后能氧化碘化鉀生成棕色溶液和NO,則該反應中氧化劑與還原劑的物質的量之比為____。
(3)如圖甲為NO2和C0反應生成CO2和NO過程的能量變化示意圖,請寫出該反應的熱化學方程式:__________________________________________________________.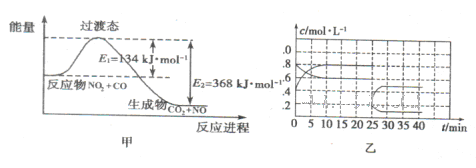
(4)已知NO2和N2O4可以相互轉化:2NO2(g) N2O4(g) △H<0。現將一定量的NO2和N2O4混合氣體通入體積為1L的恒溫密閉容器中發生上述反應,反應物的濃度隨時問變化關系如圖乙所示。
N2O4(g) △H<0。現將一定量的NO2和N2O4混合氣體通入體積為1L的恒溫密閉容器中發生上述反應,反應物的濃度隨時問變化關系如圖乙所示。
①前10 min內用NO2表示的平均反應速率v(NO2)= ;上述反應的平衡常數K=__________。
②反應進行至25 min時,曲線發生變化的原因是________________________.
③若要使上述反應的平衡常數K增大,采取的措施是_________________。
| A.加入催化劑 | B.縮小容器體積 | C.降低溫度 | D.再加入一定量的NO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
某校化學研究性學習小組學習了化學反應與能量的內容后,對CaCO3與稀鹽酸的反應進行了相關探究。他們在室溫條件下,將CaCO3塊狀固體放入1L、1mol?L-1稀鹽酸中,記錄下了隨反應時間的變化生成CO2氣體的物質的量情況,繪制成如圖曲線。假設溶液的體積變化忽略不計,請分析以下問題: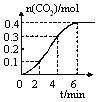
(1)若想加快該反應的速率,可以采取的措施是 、 (答兩種)。
(2)0~2min內,用HCl濃度變化表示的平均反應速率為 ,比較0~2min、2~4min、4~6min三個時間段,反應速率最大的是 。
(3)根據定量的數據,定性的描述0~6min內該反應的化學反應速率的變化情況 ;呈現這種變化的原因是 。
(4)根據圖像中曲線的變化趨勢,第8min時,該反應的反應速率為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
反應A(g)+B(g) C(g)+D(g)過程中的能量變化如圖所示,回答下列問題。
C(g)+D(g)過程中的能量變化如圖所示,回答下列問題。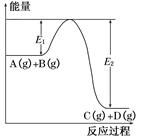
(1)該反應是________(填“吸熱”或“放熱”)反應。
(2)當反應達到平衡時,升高溫度,A的轉化率________(填“增大”“減小”或“不變”),原因是________________________________________
(3)反應體系中加入催化劑對反應熱是否有影響?________,原因是__________________________________________
(4)在反應體系中加入催化劑,反應速率增大,E1和E2的變化是:E1________,E2________。(填“增大”“減小”或“不變”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com