
【題目】磺酰氯(SO2Cl2)是一種重要的有機合成試劑,實驗室可利用SO2與Cl2在活性炭作用下反應制取少量的SO2Cl2,裝置如下圖所示(有些夾持裝置省略)。已知SO2Cl2的熔點為-54.1 ℃,沸點為69.1 ℃,遇水能發生劇烈的水解反應,并產生白霧。
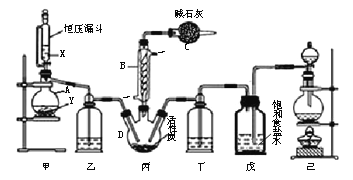
(1)單獨檢驗己裝置氣密性的方法是:_______。
(2)由儀器B的使用可知SO2與Cl2反應的ΔH_______0(填“>”或“<”),儀器C的作用是_______。
(3)試劑X、Y的組合最好是________。
a.18.4 mol/L H2SO4+Cu b.4 mol/L HNO3+Na2SO3 c.60% H2SO4+K2SO3
(4)反應結束后,將丙中產物分離的實驗操作是_______。
(5)分離產物后,向獲得的SO2Cl2中加入足量NaOH溶液,振蕩、靜止得到無色溶液w。
①寫出該反應的離子方程式:________;
②檢驗溶液w中存在Cl-的方法是________。
(6)SO2Cl2可以作為鋰離子電池的正極活性材質,已知電池反應為:2Li+SO2Cl2=2LiCl +SO2↑。則電池工作時,正極的電極反應式為_________。
【答案】 關閉分液漏斗活塞,將導管末端插入水中,加熱燒瓶,導管口有氣泡產生,停止加熱,導管內形成一段高于液面的穩定水注,則氣密性好 < 吸收尾氣Cl2、SO2,防止環境污染,同時防止空氣中的水蒸氣進入引起磺酰氯水解 c 蒸餾 SO2Cl2+4OH-=2Cl-+SO42-+2H2O 取少量w于試管中,加入足量Ba(NO3)2溶液,靜置,向上層清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,則w中存在Cl- SO2Cl2+2e-=SO2↑+2Cl-
【解析】(1)檢驗己裝置氣密性的方法是:關閉分液漏斗活塞,將導管末端插入水中,加熱燒瓶,導管口有氣泡產生,停止加熱,導管內形成一段高于液面的穩定水注,則氣密性好;
(2)根據裝置圖可知,蛇形冷凝管的作用是冷凝回流而反應又沒有加熱,故SO2與氯氣間的反應為放熱反應,由于會有一部分Cl2、SO2通過冷凝管逸出,故C中應使用堿性試劑,又因SO2Cl2遇水易水解,故堿石灰是用于吸收氯氣、SO2并防止空氣中的水蒸氣進入B中;
(3)甲是制備SO2的裝置,銅與濃硫酸反應需要加熱,硝酸能氧化SO2,所以用c.60%H2SO4+K2SO3來制備SO2,故選c;
(4)分離沸點不同的液體可以用蒸餾的方法,所以丙中混合物分離開的實驗操作是蒸餾;
(5)①SO2Cl2中加入足量NaOH溶液,使之水解,所得溶液中含有SO42-和Cl-,發生反應的離子方程式為SO2Cl2+4OH-=2Cl-+SO42-+2H2O;
②取少量w于試管中,加入足量Ba(NO3)2溶液,靜置,向上層清液加入硝酸酸化的AgNO3溶液,有白色沉淀生成,則w中存在Cl-;
(6)正極是SO2Cl2中+6價的硫得電子發生還原反應,所以電極反應式為:SO2Cl2+2e-=2Cl-+SO2↑。


科目:高中化學 來源: 題型:
【題目】堿式碳酸鎂可用于牙膏、醫藥化妝品等工業,化學式為4MgCO3·Mg(OH)2·5H2O,某堿式碳酸鎂中含有SiO2雜質,為測定其純度。某興趣小組設計了如下幾個方案:
方案1
取一定質量的樣品,與硫酸充分反應,通過測定CO2的質量計算純度

(1)乙中發生反應的方程式為______________________________ 。
(2)儀器接口的連接順序為(裝置可以重復使用) a___________,丁的作用是__________________。
(3)關閉止水夾K,向樣品中加入足量的稀硫酸,當樣品充分反應完后,為了測定準確還應進行的操作是______________________________。
方案Ⅱ
①稱取堿式碳酸鎂樣品mg;②將樣品充分高溫燃燒,冷卻后稱量;③重復操作②,測得剩余固體質量為m1g(用托盤天平稱量)。
(4)下列儀器中,該方案不會用到的是____________。

(5)判斷樣品完全分解的方法是_________________________。
(6)有同學認為方案Ⅱ高溫燃燒的過程中會發生![]()
會導致測定結果有誤,你任為這位同學的觀點正確嗎?_________,(填“正確”或“錯誤”)
請說明自己的理由:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在強酸性溶液中,下列離子組能大量共存且溶液為無色透明的是
A. Na+、K+、OH-、Cl- B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ca2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用VSEPR模型預測下列分子或離子的立體結構,其中正確的是 ( )
A. H2O與BeCl2為角形(V形) B. CS2與SO2為直線形
C. SO3與CO![]() 為平面三角形 D. BF3與PCl3為三角錐形
為平面三角形 D. BF3與PCl3為三角錐形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知3.6 g碳在6.4 g的氧氣中燃燒,至反應物耗盡,并放出X kJ熱量。已知單質C(s)的燃燒熱為Y kJ/mol,則1 mol C(s)與O2(g)反應生成CO(g)的反應熱ΔH為( )
A.-Y kJ/mol B.-(10X-Y)kJ/mol
C.-(5X-0.5Y) kJ/mol D.+(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質無論以何種比例混合,只要總的物質的量一定,完全燃燒時消耗氧氣的量為定值的是( )
A. CH2O、C2H4O2、C6H12O6
B. CH2= CH2,C2H5OH、HOCH2CH2COOH
C. C6H6O、C5H10、C7H6O2
D. H2、CO、CH3OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是一種重要的化工原料,以乙烯為原料生產部分化工產品的反應如下(部分反應條件已略去):
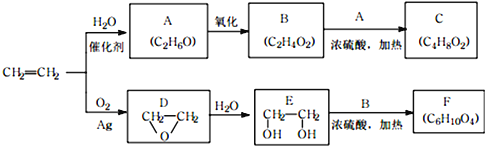
請回答下列問題:
(1)A的名稱是___________,含有的官能團名稱是_______________。
實驗室由A轉化為乙烯的反應條件為_______________。
(2)B和A反應生成C的化學方程式為_______________,該反應的類型為_______________。
(3)F的結構簡式為__________________。
(4)寫出D的同分異構體的結構簡式__________________。
(5)乙炔是常見的一種化工原料,它可以制取很多化工產品。例如:聚氯乙烯塑料。寫出由乙炔合成聚氯乙烯的合成路線。_____________
(合成路線常用的表示方式為:![]() )
)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種短周期元素,原子半徑的大小關系為:r(y)>r(x)>r(z),原子序數之和為16。X、Y、Z三種元素的常見單質在適當條件下可發生下圖所示變化,其中B和C均為10電子分子。下列說法不正確的是

A. X元素位于ⅥA
B. A不能溶解于B中
C. B的沸點高于C的沸點
D. A和C不可能發生氧化還原反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com