
下列說法正確的是
| A.往沸水中滴入幾滴飽和FeCl3溶液,繼續煮沸至溶液呈紅褐色,可制得Fe(OH)3膠體 |
B.CO2溶于水中,只存在平衡:CO2+H2O H2CO3 H2CO3 |
| C.在潮濕的空氣中,生鐵比純鐵更耐腐蝕 |
| D.實驗室可用濃H2SO4制備HCl,這是因為H2SO4的酸性比HCl強 |
A
解析試題分析:在沸水中加入幾滴飽和氯化鐵溶液,使氯化鐵的水解平衡向生成氫氧化鐵的方向移動,當溶液變為紅褐色時,就制取了氫氧化鐵膠體,故A正確;二氧化碳溶于水時,不僅存在二氧化碳的溶解平衡,還存在碳酸的電離平衡:H2CO3 H++HCO3-等,故B錯誤;生鐵是Fe—C合金,在潮濕的空氣中可形成原電池,鐵作負極,發生吸氧腐蝕或析氫腐蝕,而純鐵不能形成原電池,所以生鐵更容易腐蝕,故C錯誤;硫酸、氯化氫都能完全電離,都是強酸,實驗室用濃硫酸制取氯化氫的原因是濃硫酸的沸點高于氯化氫,或者濃硫酸的揮發性小于氯化氫,故D錯誤。
H++HCO3-等,故B錯誤;生鐵是Fe—C合金,在潮濕的空氣中可形成原電池,鐵作負極,發生吸氧腐蝕或析氫腐蝕,而純鐵不能形成原電池,所以生鐵更容易腐蝕,故C錯誤;硫酸、氯化氫都能完全電離,都是強酸,實驗室用濃硫酸制取氯化氫的原因是濃硫酸的沸點高于氯化氫,或者濃硫酸的揮發性小于氯化氫,故D錯誤。
考點:考查元素化合物的主要性質及制備,涉及氫氧化鐵膠體的制取方法、二氧化碳溶于水后的化學平衡、生鐵和純鐵的腐蝕、濃硫酸的難揮發性等。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:單選題
已知A 、B、C、D之間的轉化關系如圖所示。下列說法正確的是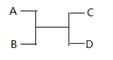
A.若A為Fe,D為氫氣,則B一定為酸
B.若A、D為化合物,B為水,則C一定是氣體單質
C.若A、B、C、D均為化合物,該反應一定屬于復分解反應
D.若A、B、C、D均為10電子微粒,且C是可使濕潤的紅色石蕊試紙變藍的氣體,則D常溫下一定呈液態
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關物質的性質及應用均正確的是 ( )
| A.常溫下濃硫酸能使鋁發生鈍化,可在常溫下用鋁制容器貯藏貯運濃硫酸 |
| B.氫氧化鐵膠體具有很強的吸附性,可用于除去水中的所有雜質 |
| C.二氧化氯具有還原性,可用于自來水的殺菌消毒 |
| D.銅的金屬活潑性比鐵的差,可在海輪外殼上裝若干銅塊以減緩其腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關說法不正確的是
| A.明礬凈化水是因為明礬的水解產物有吸附作用 |
| B.FeCl3溶液腐蝕銅電路板的過程發生了置換反應 |
| C.氨氧化法制硝酸的過程中有NO2生成 |
| D.氯堿工業中,NaOH是在陰極室中產生的 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
根據下列實驗現象得出的結論,正確的是
| 選項 | 實驗現象 | 結論 |
| A | 某氣體能使潤濕的淀粉碘化鉀試紙變藍 | 該氣體一定是氯氣 |
| B | 向某溶液中加入鹽酸酸化的BaCl2,有白色沉淀生成 | 該溶液中一定存在SO42- |
| C | 鐵與稀硝酸充分反應后,溶液呈淺綠色 | 稀硝酸與鐵反應只能生成Fe2+ |
| D | SO2通入溴水中,溴水褪色 | SO2具有還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列陳述I、II正確并且有因果關系的是( )
| 選項 | 陳述I | 陳述II |
| A | Fe2(SO4)3可以做凈水劑 | Fe 3+水解成膠體可吸附水中的細小懸浮物 |
| B | 向Ba(NO3)2溶液中通入足量SO2,無明顯現象 | 弱酸不能制強酸 |
| C | Cl2能使濕潤的布條褪色 | Cl2具有漂白性 |
| D | 電解NaCl溶液制備金屬鈉 | NaCl是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關化學反應過程的敘述中,錯誤的是
| A.船底鑲嵌鋅塊,鋅作負極,以防船體被腐蝕 |
| B.除去CO2中的少量SO2:通過盛有飽和NaHCO3溶液的洗氣瓶 |
| C.漂白粉和明礬都常用于自來水的處理,二者的作用原理是相同的 |
| D.金屬鈉在空氣中燃燒產生黃色火焰,生成淡黃色固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
| A.硅和石墨都是重要的半導體材料 |
| B.SO2、NO2、CO2都會導致酸雨的形成 |
| C.明礬和漂白粉常用于自來水的凈化和殺菌消毒,兩者的作用原理不同 |
| D.氫能是清潔能源,工業上用電解水法制大量氫氣符合節能減排理念 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氯化銅是一種廣泛用于生產顏料、木材防腐劑等的化工產品。某研究小組用粗銅(含雜
質Fe)按下述流程制備氯化銅晶體(CuCl2·2H2O)。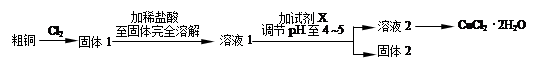
(1)實驗室采用如下圖所示的裝置,可將粗銅與Cl2反應轉化為固體1(部分儀器和夾持裝置已略去)。
① 儀器A的名稱是 。
② 裝置B中發生反應的離子方程式是 。
③ 有同學認為應在濃硫酸洗氣瓶前增加吸收HCl的裝置,你認為是否必要
(填“是”或“否”) 。
(2)試劑X用于調節pH以除去雜質, X可選用下列試劑中的(填序號) 。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
(3)在溶液2轉化為CuCl2·2H2O的操作過程中,發現溶液顏色由藍色變為綠色。小組同學欲探究其原因。
已知:在氯化銅溶液中有如下轉化關系:
Cu(H2O)42+(aq) +4Cl-(aq) CuCl42-(aq) +4H2O(l)
CuCl42-(aq) +4H2O(l)
藍色 綠色
① 上述反應的化學平衡常數表達式是K= 。若增大氯離子濃度,K值(填“增大”、“減小”或“不變”) 。
② 取氯化銅晶體配制成藍綠色溶液Y,進行如下實驗,其中能夠證明CuCl2溶液中有上述轉化關系的是(填序號) 。
a.將Y稀釋,發現溶液呈藍色
b.在Y中加入CuCl2晶體,溶液變為綠色
c.在Y中加入NaCl固體,溶液變為綠色
d.取Y進行電解,溶液顏色最終消失
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com