
【題目】下列A~I九種中學化學常見的物質之間的轉化關系如圖所示,已知A為固態(tài)非金屬單質,B在實驗室常用作氣體干燥劑,D為常見液體,常溫下C、E、F都是無色氣體,E能使酸性高錳酸鉀溶液褪色,G是侯氏制堿法的最終產品。

(1)B的名稱為________,圖中淡黃色固體物質中的陰、陽離子個數比為_________。
(2)E轉變?yōu)?/span>H和I的離子方程式是___________________,體現了E的_______性。
(3)E能使酸性高錳酸鉀溶液褪色的離子方程式為______________________________。
【答案】濃硫酸 1:2 SO2+Cl2+2H2O=4H++SO42-+2Cl- 還原性 5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
【解析】
根據圖中各物質轉化關系,A為固態(tài)非金屬單質,B在實驗室常用作氣體干燥劑,常溫下C、E、F都是無色氣體,則A與B的反應為碳與濃酸硫的反應,E能與黃綠色溶液(應為氯水)反應,生成I遇氯化鋇有白色沉淀,則I中應含有硫酸根,I為H2SO4,H為HCI,所以A為C,B為濃H2SO4,E為SO2,D為H2O,C是氣體能與淡黃色固體反應,則應為二氧化碳與過氧化鈉的反應,所以C為CO2,F為O2,G為Na2CO3,HCI與Na2CO3反應生成二氧化碳、氯化鈉和水,符合各物質轉化關系,據此答題.
(1)根據上述分析得B為濃H2SO4,B的名稱為濃硫酸,題中淡黃色固體為過氧化鈉,過氧化鈉中陰陽離子個數比為1:2,本題答案為:濃硫酸;1:2;
(2)E(SO2)轉變?yōu)?/span>H(HCI)和I(H2SO4)的離子方程式是:SO2+Cl2+2H2O=4H++2Cl-+SO42-,體現了E(SO2)的還原性,故答案為:SO2+Cl2+2H2O=4H++SO42-+2Cl-;還原性;
(3)E(SO2)能使酸性高錳酸鉀溶液褪色的離子方程式為:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+,本題答案為:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+


科目:高中化學 來源: 題型:
【題目】現有一定量含有Na2O雜質的Na2O2試樣,用如圖的實驗裝置測定Na2O2試樣的純度。
回答下列問題:

(1)裝置A中盛放稀鹽酸的儀器名稱為__________________。
(2)裝置B的作用是______________________________________。
(3)裝置C的作用是____________________________________________。
(4)裝置D中發(fā)生反應的化學方程式是_____________、_______________。
(5)裝置E中堿石灰的作用是______________________________________。
(6)若開始時稱得樣品的質量為4.52 g,反應結束后稱得固體的質量為6.36g,則Na2O2試樣的純度為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如表提供的數據可知,在溶液中能大量共存的微粒組是

A. H2CO3 、HCO3-、CH3COO-、CN-
B. CO32-、 HCO3-、CH3COOH、CN-
C. HCO3-、CH3COO-、CN-、HCN
D. HCN 、HCO3-、CN-、CO32-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu、Ni、V為制造合金及合成催化劑的重要元素。請回答:
(1)基態(tài)銅原子的電子排布式是_________________。基態(tài)銅原子價電子層排布依據的原理,可用于解釋下列事實的是___________。
A.Fe2+易被氧化為Fe3+ B.銅絲灼燒時焰色呈綠色
C.N的第一電離能大于O的第一電離能 D.NaCl的熔點比KCl的高
(2)[Cu(NH3)4]SO4是一種重要的配合物。與SO42-互為等電子體的分子的化學式為__________(任寫一種)。NH3與CH4的VSPER構型相同,其中NH3的鍵角較小,原因是____________。Ni(CO)4中σ鍵和π鍵的數目之比為_________。
(3)釩的某種配合物有增強胰島素和降糖作用,其分子結構如圖所示。
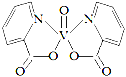
① 基態(tài)V元素的價層電子軌道表示式______________________,分子中非金屬元素電負性由大到小的順序為________。
② 該物質的晶體中除配位鍵外,所含微粒間作用力的類型還有___________(填序號)。
a.金屬鍵 b.極性鍵 c.非極性鍵 d.范德華力 e.氫鍵
③ 1mol分子中含有配位鍵的數目是______,分子中采取sp2雜化的原子有_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海帶中含有豐富的碘。為了從海帶中提取碘,某研究性學習小組設計并進行了以下實驗:
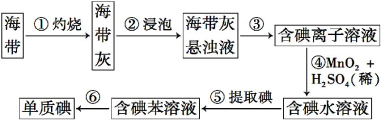
請?zhí)顚懴铝锌瞻?
(1)步驟①灼燒海帶時,除需要三腳架外,還需要用到的實驗儀器是_________(從下列儀器中選出所需的儀器,用標號字母填寫空白處)。
A.燒杯
B.坩堝
C.表面皿
D.泥三角
E.酒精燈
F.干燥器
(2)步驟③的實驗操作名稱是 ;步驟⑥的目的是從含碘的苯溶液中分離出單質碘和回收苯,該步驟的實驗操作名稱是 。
(3)步驟④反應的離子方程式是 。
(4)步驟⑤中,某學生選擇用苯來提取碘的理由是 。
(5)請設計一種檢驗提取碘后的水溶液中是否還含有單質碘的簡單方法: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把含硫酸銨和硝酸銨的混合液a L分成兩等份.一份加入含b mol NaOH的溶液并加熱,恰好把NH3全部趕出;另一份需消耗c mol BaCl2才能使SO42-完全沉淀,則原溶液中NO3-的物質的量濃度為( )
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1774年,瑞典化學家舍勒在研究軟錳礦(主要成分是MnO2)的過程中,將其與濃鹽酸混合加熱,產生黃綠色氣體,反應的化學方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)反應中氧化劑是______(填化學式),錳元素的化合價______(填“升高”或“降低”)。
(2)若消耗了1 mol MnO2,則生成標準狀況下Cl2的體積是______L,轉移電子的物質的量是______mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用已知物質的量濃度的標準鹽酸測定未知物質的量濃度的NaOH溶液時,選擇甲基橙作指示劑。請?zhí)顚懴铝锌瞻祝?/span>
(1)用含有少量雜質(雜質不與鹽酸反應)的固體燒堿樣品配制500mL溶液。除燒杯、量筒、膠頭滴管和玻璃棒外,還需要的玻璃儀器是___________。取用25.00mL待測液時需要的儀器是_____________。
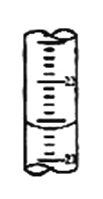
(2)滴定過程中,在錐形瓶底墊一張白紙的作用是_______________;若甲學生在實驗過程中,記錄滴定前滴定管內液面讀數為0.50mL,滴定后液面如圖(上面數字:22,下面數字:23)。,則此時消耗標準溶液的體積為_________mL
(3)下列操作中可能使所測NaOH溶液的濃度數值偏高的是________。
A.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
B.滴定前盛放NaOH溶液的錐形瓶用蒸餾水洗凈但沒有干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.酸式滴定管未用標準鹽酸潤洗就直接注入標準鹽酸
(4)用標準鹽酸滴定上述待測NaOH溶液時,判定滴定終點的現象是:直到加入最后一滴鹽酸,_____________________________為止。
(5)某學生根據3次實驗分別記錄有關數據如下表:
滴定次數 | 待測NaOH溶液的體積/mL | 0.1000mol/L鹽酸的體積/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液體積/mL | ||
第一次 | 25.00 | 0.00 | 26.28 | 26.28 |
第二次 | 25.00 | 1.55 | 31.30 | 29.75 |
第三次 | 25.00 | 0.20 | 26.42 | 26.22 |
計算該NaOH溶液的物質的量濃度:c(NaOH)=__________mol/L。(保留四位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2NO2(g)![]() 2NO(g)+O2(g)在體積固定的密閉容器中進行,達到平衡狀態(tài)的標志是( )
2NO(g)+O2(g)在體積固定的密閉容器中進行,達到平衡狀態(tài)的標志是( )
①單位時間內生成n mol O2的同時生成2n mol NO2
②單位時間內生成n mol O2的同時生成2n mol NO
③用NO2、NO、O2表示的反應速率之比為2∶2∶1的狀態(tài)
④混合氣體的顏色不再改變的狀態(tài) ⑤混合氣體的密度不再改變的狀態(tài)
⑥混合氣體的壓強不再改變的狀態(tài) ⑦混合氣體的平均相對分子質量不再改變的狀態(tài)
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com