
【題目】已知A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于短周期。A是原子半徑最小的元素;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同;D原子的核外成對電子數是未成對電子數的3倍;E有“生物金屬”之稱,E4+和氬原子的核外電子排布相同。A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B兩種元素組成的原子個數之比為1 : 1的化合物N是常見的有機溶劑。
請回答下列問題(答題時,A、B、C、D、E用所對應的元素符號表示):
(1)A2D2分子的電子式為____________,屬于___________分子(填“極性”或“非極性”),E的基態原子的外圍電子排布式為____________。
(2)B、C、D三種元素的第一電離能由小到大的順序為____________。
(3)C元素形成含氧酸酸性強弱:HNO3____________HNO2(填“>”或“<”)NO3—的空間構型是___________,NO2—中心原子的雜化方式為___________
(4)下列敘述正確的是____________(填序號)。
A. M是極性分子,N是非極性分子
B. M和BD2分子中的中心原子均采用sp2雜化
C. N分子中含有6個σ鍵和1個大π鍵
D. BD2晶體的熔點、沸點都比二氧化硅晶體的低
(5)已知:①E的一種氧化物Q,其晶胞結構如圖所示:

①Q(s)+2Cl2(g)=ECl4(l)+D2(g) △H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
寫出物質Q和焦炭、氯氣反應生成液態ECl4和BD氣體的熱化學方程式:____________________
【答案】
(1)![]() ;極性;3d24s2;
;極性;3d24s2;
(2)C<O<N;
(3)>; 平面三角形;sp2 雜化;
(4)AD
(5)TiO2(s) +2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) △H=-81kJ/mol
【解析】
試題分析:A、B、C、D、E五種元素的原子序數依次遞增,A、B、C、D位于前三周期,A是原子半徑最小的元素,則A為氫元素;B的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子總數相同,原子核外電子數排布為1s22s22p2,故B為碳元素;D原子的核外成對電子數是未成對電子數的3倍,核外電子排布為1s22s22p4,故D為氧元素;C原子序數介于碳、氧之間,故C為氮元素;A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,該氣體M為HCHO;A、B二種元素組成的原子個數比為1:1的化合物N是常見的有機溶劑,則N為苯;E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同,E原子核外電子數為18+4=22,故E為Ti。
(1)A2D2分子為H2O2,其電子式為![]() ,分子中電荷分布不均勻,屬于極性分子;E為Ti,原子序數為22,其基態原子的外圍電子排布式為3d24s2,故答案為:
,分子中電荷分布不均勻,屬于極性分子;E為Ti,原子序數為22,其基態原子的外圍電子排布式為3d24s2,故答案為:![]() ;極性;3d24s2;
;極性;3d24s2;
(2)同周期自左而右第一電離能增大,但N原子p軌道半滿,為穩定狀態,故第一電離能C<O<N,故答案為:C<O<N;
(3)同一元素的含氧酸,該元素的化合價越高,對應的含氧酸的酸性越強,故酸性:HNO3>HNO2,NO3—中N原子的價層電子對數為3+![]() (5+1-2×3)=3,含有一個孤電子對,屬于平面三角形,NO2—中N原子的價層電子對數為2+
(5+1-2×3)=3,含有一個孤電子對,屬于平面三角形,NO2—中N原子的價層電子對數為2+![]() (5+1-2×2)=3,采取sp2雜化,故答案為:>; 平面三角形;sp2 雜化;
(5+1-2×2)=3,采取sp2雜化,故答案為:>; 平面三角形;sp2 雜化;
(4)A.HCHO中O氧原子電負性很大,是極性分子,N為苯,是非極性分子,故A正確;B.HCHO中C原子形成3個σ鍵,沒有孤電子對,碳原子采用sp2雜化,二氧化碳分子為直線型結構,碳原子采用sp雜化,故B錯誤;C.苯分子中H-C之間是s-sp2形成的σ鍵,C-C之間是sp2形成的σ鍵,苯分子中含有12個σ鍵和1個大π鍵,故C錯誤;D.CO2屬于分子晶體,二氧化硅屬于原子晶體,二氧化碳的熔點、沸點都比二氧化硅晶體的低,故D正確,故選:AD;
(5)晶胞中Ti原子數目為1+8×![]() =2,氧原子數目為2+4×
=2,氧原子數目為2+4×![]() =4,故氧化物Q的化學式為TiO2,①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140kJ/mol,②2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,根據蓋斯定律,將①+②可得TiO2和焦炭、氯氣反應生成液態TiCI4和CO氣體的熱化學方程式為2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g)△H=-81kJ/mol,故答案為:2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g) △H=-81kJ/mol。
=4,故氧化物Q的化學式為TiO2,①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140kJ/mol,②2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,根據蓋斯定律,將①+②可得TiO2和焦炭、氯氣反應生成液態TiCI4和CO氣體的熱化學方程式為2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g)△H=-81kJ/mol,故答案為:2C(s)+TiO2(s)+2Cl2(g)=TiCl4(l)+2CO(g) △H=-81kJ/mol。


 全優測試卷系列答案
全優測試卷系列答案 沖刺100分1號卷系列答案
沖刺100分1號卷系列答案科目:高中化學 來源: 題型:
【題目】“綠色化學”的主要內容之一是指從技術、經濟上設計可行的化學反應,使原子充分利用,不產生污染物。下列化學反應符合“綠色化學”理念的是( )
A.制CuSO4:Cu+2H2SO4(濃)=CuSO4+SO2↑+2H2O
B.制CuSO4:2Cu+O2=2CuO;Cu+H2SO4(稀)=CuSO4+H2O
C.制Cu(NO3)2:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O
D.制Cu(NO3)2:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知反應 2HI(g)![]() H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1mol HI(g)分子中化學鍵斷裂時需吸收的能量為_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化學鍵斷裂時分別需要吸收436kJ、151kJ的能量,則1mol HI(g)分子中化學鍵斷裂時需吸收的能量為_________kJ。
(2)Bodensteins 研究了下列反應:2HI(g) ![]() H2(g)+I2(g)在 716 K 時,氣體混合物中碘化氫的物質的量分數 x(HI)與反應時間 t 的關系如下表:
H2(g)+I2(g)在 716 K 時,氣體混合物中碘化氫的物質的量分數 x(HI)與反應時間 t 的關系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根據上述實驗結果,該反應的平衡常數K的計算式為__________。
②上述反應中,正反應速率為v正=k正x2(HI),逆反應速率為v逆=k逆x(H2)x(I2),其中k正、k逆為速率常數,則k逆為__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 時,v正=_________ min-1。
③由上述實驗數據計算得到v正~x(HI)和 v逆~x(H2)的關系如圖所示。當升高到某一溫度時,反應重新達到平衡,相應的點依次為__________(填字母)和__________(填字母)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從古至今,鐵及其化合物在人類生產生活中的作用發生了巨大變化。
(1)古代中國四大發明之一的指南針是由天然磁石制成的,其主要成分是______(填字母序號)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化學成分為:SiO2約45%,Fe2O3約40%,Al2O3約10%,MgO約5%。用該廢渣制取藥用輔料——紅氧化鐵的工藝流程如下(部分操作和條件略):
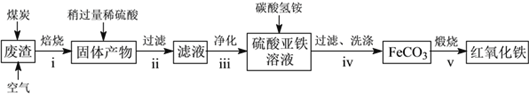
回答下列問題:
①在步驟i中產生的有毒氣體可能有__________________。
②在步驟iii操作中,要除去的離子之一為Al3+。若常溫時Ksp[Al(OH)3]=1.0×10-32,此時理論上將Al3+沉淀完全,則溶液的pH為____________。
③步驟iv中,生成FeCO3的離子方程式是_________________。
(3)氯化鐵溶液稱為化學試劑中的“多面手”,向氯化銅和氯化鐵的混合溶液中加入氧化銅粉末會產生新的沉淀,寫出該沉淀的化學式_________________。請用平衡移動的原理,結合必要的離子方程式,對此現象作出解釋:___________________。
(4)①古老而神奇的藍色染料普魯士藍的合成方法如下:

復分解反應ii的離子方程式是________________。
②如今基于普魯士藍合成原理可檢測食品中CN-,方案如下:
![]()
若試紙變藍則證明食品中含有CN-,請解釋檢測時試紙中FeSO4的作用:
_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測定平衡常數對定量認識化學反應具有重要意義。已知:I2能與 I-反應生成 I3-,并在溶液中建立如下平衡: I2+I-![]() I3-。通過測平衡體系中 c(I2)、 c(I-)和 c(I3-),就可求得該反應的平衡常數。
I3-。通過測平衡體系中 c(I2)、 c(I-)和 c(I3-),就可求得該反應的平衡常數。
Ⅰ.某同學為測定上述平衡體系中 c(I2),采用如下方法:取 V1 mL 平衡混合溶液,用cmol·L-1的Na2S2O3溶液進行滴定(反應為 I2+2Na2S2O3=2NaI+Na2S4O6),消耗 V2 mL 的Na2S2O3溶液。根據V1、V2和c可求得c(I2)。
(1)上述滴定時,可采用________做指示劑,滴定終點的現象是_____________________。
(2)下列對該同學設計方案的分析,正確的是________(填字母)。
A.方案可行。能準確測定溶液中的 c(I2)
B.不可行。因為 I-能與 Na2S2O3發生反應
C.不可行。只能測得溶液中 c(I2)與 c(I3-)之和
Ⅱ.化學興趣小組對上述方案進行改進,擬采用下述方法來測定該反應的平衡常數(室溫條件下進行,溶液體積變化忽略不計):

已知: ①I-和 I3-不溶于 CCl4; ②一定溫度下, 碘單質在四氯化碳和水混合液體中,碘單質的濃度比值即![]() 是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
(3)操作Ⅰ使用的玻璃儀器中,除燒杯、玻璃棒外,還需要的儀器是________(填名稱)。試指出該操作中應注意的事項為________。 (任寫一條)
(4)上述測定過程均正常操作,下層液體中碘單質的物質的量濃度是________;若終點讀數時俯視滴定管, 則會造成所測濃度________ (填“等于”、 “大于”或“小于”)該值。
(5)實驗測得上層溶液中 c(I3-)=0.0049 mol·L-1,結合上述有關數據,計算室溫條件下反應 I2+I-![]() I3-的平衡常數 K=________(用具體數據列出計算式即可)。
I3-的平衡常數 K=________(用具體數據列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酸根RO3﹣所含電子數比硝酸根離子(NO3﹣)的電子數多10,下列說法中正確的是( )
A.R是第三周期元素
B.R元素的最高正價與N元素最高正價相同
C.RO3﹣和NO3﹣均只能被還原,不能被氧化
D.R和N兩元素的單質都是空氣的主要成分
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鳳凰石是一種用于建材裝飾的硅酸鹽礦物,已知某地出產的鳳凰石可看作由主要成分硅酸銅鹽X·3H2O(摩爾質量=334g/mol)與含氧酸鹽雜質Y共同組成,X、Y均含三種元素,工業上利用下列流程制備銅鹽,在溶液Ⅱ中滴入KSCN溶液顯血紅色。

請回答:
(1)雜質Y中除氧以外還含有的元素為_____(填元素符號),x的化學式為_______。
(2)如果王溶液Ⅱ中繼續加入H2O2,發現有氣泡產生,有觀點認為是Y中的某元素離子將H2O2氧化所導致,寫出反應的離子方程式__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫下,V升容器中加入a mol HI使之分解:2HI(g) ![]() H2(g)+I2(g),反應達到平衡狀態后,下列推測正確的是( )
H2(g)+I2(g),反應達到平衡狀態后,下列推測正確的是( )
A. 減壓時,v(逆)增大,v(正)減小,平衡向逆反應方向移動
B. 若加入2a mol HI,則平衡常數變為2倍
C. 加壓時,v(逆)、v(正)均不變,平衡不移動
D. 若保持壓強不變,通入氦氣,則v(逆)、v(正)均減小,平衡不移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩份15mL、1mol/L的Ba(OH)2溶液中,分別滴入H2SO4、NaHSO4溶液,其導電能力隨滴入溶液體積變化的曲線如右圖所示。下列分析不正確的是

A. o-b段,發生的離子方程式:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B. bd段,發生的離子方程式:OH-+H+=H2O
C. c點,兩溶液中陰、陽離子的濃度之和相等
D. o-a段加入溶液的體積為20mL,則NaHSO4溶液的濃度為0.75mol/L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com