
【題目】常溫下向25mL0.1mol/LNaOH溶液中逐滴滴加0.2mol/L的HN3(疊氮酸)溶液,pH的變化曲線如圖所示(溶液混合時體積的變化忽略不計,疊氮酸的Ka=10—4.7)。下列說法正確的是
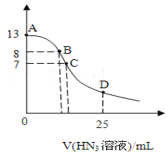
A.水電離出的c(H+):A點大于B點
B.從A點到C點,都存在c(Na+)>c(N3—)>c(OH—)>c(H+)
C.在C點,滴加的V(HN3)>12.5mL
D.在D點,c(Na+)=2c(HN3)+2c(N3—)
【答案】C
【解析】
A.酸或堿抑制水電離,弱離子促進水的電離,A點溶質為NaOH、B點溶質為NaOH和NaN3,所以水的電離程度:A<B,則水電離出的c(H+):A點小于B點,故A錯誤;
B.在接近A點,溶液中溶質為HN3和NaOH,且c(NaOH)遠遠大于c(HN3),所以c(N3-)<c(OH-),故B錯誤;
C.疊氮酸鈉是強堿弱酸鹽,其水溶液呈堿性,要使混合溶液呈中性,疊氮酸應該稍微過量,酸的濃度是堿的2倍,則C點滴加的V(HN3)>12.5mL,故C正確;
D.D點溶液中溶質為HN3和NaN3且二者的物質的量濃度相等,溶液中存在物料守恒2c(Na+)=c(HN3)+c(N3-),故D錯誤;
故選C。


 53隨堂測系列答案
53隨堂測系列答案科目:高中化學 來源: 題型:
【題目】觀察下列A、B、C、D、E五種粒子(原子或離子)的結構示意圖,回答有關問題。
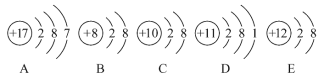
(1)與離子相對應的元素的符號是_________,與原子相對應的離子的結構示意圖是__________
(2)電子層結構相同的是(填寫代號,在本小題中下同)_______,性質最穩定的是______,最容易失去電子的是_______,最容易得到電子的是_______。
(3)可直接相互結合形成化合物的化學式是_______,可經過得失電子后再相互結合形成化合物的化學式是__________。
(4)在核電荷數1~10的元素內,列舉兩個與B電子層結構相同的離子,寫出離子的符號_______________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用鋁土礦(主要成分為Al2O3,還含有Fe2O3、FeO、SiO2)制備鋁的某種化合物的工藝流程如下,下列有關說法不正確的是( )
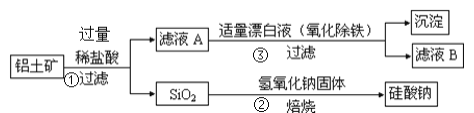
A.向濾液A中加入KSCN溶液,溶液一定會變紅
B.![]() 的離子反應方程式為
的離子反應方程式為![]()
C.![]() 漂白液的目的是氧化除鐵,該過程中涉及的氧化還原反應為
漂白液的目的是氧化除鐵,該過程中涉及的氧化還原反應為![]()
D.![]() 中漂白液要適量,若過量則可能產生有毒的氣體氯氣
中漂白液要適量,若過量則可能產生有毒的氣體氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】赤銅礦的成分是 Cu2O,輝銅礦的成分是 Cu2S,將赤銅礦與輝銅礦混合加熱有以下反應:Cu2S + 2Cu2O![]() 6Cu + SO2↑,對于該反應的下列說法正確的是( )
6Cu + SO2↑,對于該反應的下列說法正確的是( )
A.該反應中的氧化劑只有 Cu2O
B.Cu2S 在反應中既是氧化劑又是還原劑
C.Cu 既是氧化產物又是還原產物
D.氧化產物與還原產物的物質的量之比為 6∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫元素最常見和最穩定的一種同素異形體是黃色的正交α-型,1912年E.Beckmann由硫在碘中的冰點降低法測得它含有S8分子。1891年,M.R.Engel用濃鹽酸和硫代硫酸鹽的飽和溶液在0℃下作用首次制得了一種菱形的![]() -硫,后來證明含有S6分子。下列說法正確的是
-硫,后來證明含有S6分子。下列說法正確的是
A.S6和S8分子都是由S原子組成,所以它們是一種物質
B.S6和S8分子分別與鐵粉反應,所得產物不同
C.S6和S8分子分別與過量的氧氣反應可以得到SO3
D.等質量的S6和S8分子分別與足量的KOH反應,消耗KOH的物質的量相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一種正投入生產的大型蓄電系統,放電前,被膜隔開的電解質為Na2S2和NaBr3,放電后分別變為Na2S4和NaBr。下列敘述正確的是

A.放電時,負極反應為3NaBr—2e—=NaBr3+2Na+
B.充電時,陽極反應為2Na2S2—2e—=Na2S4+2Na+
C.充電時,Na+經過離子交換膜,由b池移向a池
D.用該電池電解飽和食鹽水,產生2.24LH2(標況下)時,b池生成17.40gNa2S4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(室溫下與水緩慢反應)是一種新型無機材料,廣泛應用于集成電路生產領域。化學研究小組同學按下列流程制取氮化鋁并測定所得產物中AlN的質量分數。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
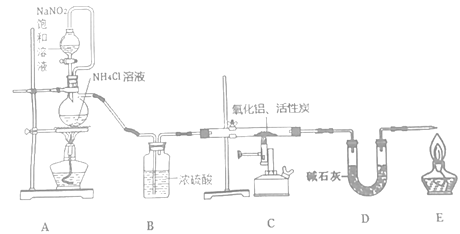
回答下列問題:
(1)檢查裝置氣密性,加入藥品,開始實驗。最先點燃___(“A”、“C”或“E”)處的酒精燈或酒精噴燈。
(2)裝置A中發生反應的離子方程式為___,裝置C中主要反應的化學方程式為___,制得的AlN中可能含有氧化鋁、活性炭外還可能含有___。
(3)實驗中發現氮氣的產生速率過快,嚴重影響尾氣的處理。實驗中應采取的措施是___(寫出一種措施即可)。
(4)稱取5.0g裝置C中所得產物,加入NaOH溶液,測得生成氨氣的體積為1.68 L(標準狀況),則所得產物中AlN的質量分數為___。
(5)也可用鋁粉與氮氣在1000℃時反應制取AlN。在鋁粉中添加少量NH4Cl固體并充分混合,有利于AlN的制備,共主要原因是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室在 500℃時,隔絕空氣加熱硫酸亞鐵銨[(NH4)2Fe(SO4)2]至分解完全并確定分解產物成分的裝置如圖所示 (已知分解的固體產物可能有 FeO、Fe2O3 和 Fe3O4,氣體產物可能有 NH3、N2、H2O、SO3 和 SO2)。下列說法正 確的是( )

A. 取①中固體殘留物與稀硫酸反應并滴加 KSCN,溶液變紅,則殘留物一定為 Fe2O3
B. 裝置②用于檢驗分解產物中是否有水蒸氣生成,試劑 X 最好選用堿石灰
C. 裝置③用于檢驗分解產物中是否有 SO3 氣體生成并除去 SO3 和 NH3
D. 裝置④用于檢驗分解產物中是否有 SO2 氣體生成,裝置⑤用于收集生成的 NH3 和 N2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一密閉容器中,反應mA(g)+nB(g) ![]() pC(g)達到平衡時,測得c(A)為0.5 mol·L-1;在溫度不變的條件下,將容器體積擴大一倍,當達到平衡時,測得c(A)為0.3 mol·L-1。則下列判斷正確的是
pC(g)達到平衡時,測得c(A)為0.5 mol·L-1;在溫度不變的條件下,將容器體積擴大一倍,當達到平衡時,測得c(A)為0.3 mol·L-1。則下列判斷正確的是
A. 化學計量數:m+n>p B. 平衡向正反應方向移動了
C. 物質B的轉化率增大了 D. 物質C的質量分數增加了
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com