
工業上合成氨的反應:N2(g)+3H2(g)  2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在絕熱、容積固定的密閉容器中發生反應:N2(g)+3H2(g)  2NH3(g),下列說法能說明上述反應向正反應方向進行的是________(填序號)。
2NH3(g),下列說法能說明上述反應向正反應方向進行的是________(填序號)。
①單位時間內生成2n mol NH3的同時生成3n mol H2
②單位時間內生成6n mol N—H鍵的同時生成2n mol H—H鍵
③用N2、H2、NH3的物質的量濃度變化表示的反應速率之比為1∶3∶2
④混合氣體的平均摩爾質量增大
⑤容器內的氣體密度不變
(2)已知合成氨反應在某溫度下2 L的密閉容器中進行,測得如下數據:
| 時間(h) 物質的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
科目:高中化學 來源: 題型:填空題
在一恒溫、恒容密閉容器中充入1mol CO2和3 mol H2,一定條件下發生反應:
CO2(g)+3H2(g) CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
CH3OH (g)+H2O(g) △H=-49.0 kJ/mol
某種反應物和生成物的濃度隨時間變化如圖所示。回答下列問題: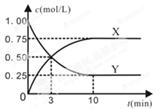
(1)Y的化學式是 。
(2)反應進行到3min時, v正 v逆(填“>”或“<”、“=”)。反應前3min,H2的平均反應速率v(H2)= mol·L-1·min-1。
(3)不能判斷該反應達到化學平衡狀態的依據是 。
| A.容器內各氣體的體積比保持不變 | B.混合氣體密度不變 |
| C.3v逆(CH3OH) =v正(H2) | D.H2轉化率為75% |
 CO2(g) + 3H2(g)的平衡常數K= (計算結果保留2位小數)。
CO2(g) + 3H2(g)的平衡常數K= (計算結果保留2位小數)。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
2014年初,霧霾天氣多次肆虐我國中東部地區。其中,汽車尾氣是造成空氣污染的原因之一。汽車尾氣凈化的主要原理為2NO(g)+2CO(g)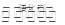 2 CO2(g)+N2(g)。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如下圖所示。
2 CO2(g)+N2(g)。在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如下圖所示。
(1)該反應的△H 0(選填“>’’、“<")。
(2)在T2溫度下,0~2 s內的平均反應速率v(N2)=
(3)當固體催化劑的質量一定時,增大其表面積可提高化學反應速率。若催化劑的表面積S1>S2,在上圖中畫出c(CO2)在T1、S2條件下達到平衡過程中的變化曲線。
(4)若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是 (填代號)。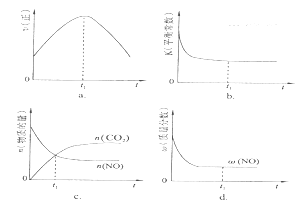
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(I)在一定條件下,發生反應:aA(g)+bB(g) cC(g)△H="Q" kJ/mol,其化學平衡常數K和溫度的關系如下表所示:
cC(g)△H="Q" kJ/mol,其化學平衡常數K和溫度的關系如下表所示:
依據圖表判斷該反應△H 0(填“>”或“<”):若其它條件保持一定,降低溫度,該反應物A的轉化率 (填“增大”、“減小”或“不變”下同),化學反應速率將 。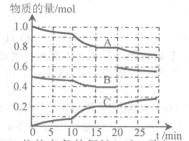
 (II)在恒定溫度t℃,2L恒容密閉容器中發生反應aA(g)+bB(g) cC(g),容器中A、B、C物質的量變化如圖所示,回答下列問題:
(II)在恒定溫度t℃,2L恒容密閉容器中發生反應aA(g)+bB(g) cC(g),容器中A、B、C物質的量變化如圖所示,回答下列問題:
(1)該化學方程式中a:b:c為 ,t℃時該反應的化學平衡常數K的值為____ 。(保留2位小數)
(2)0~15 min內,B的平均反應速率為 ,反應達平衡時,A的轉化率為 。
(3)據圖判斷,反應進行至20 min時,曲線發生變化的原因是 (用文字表達),反應重新達平衡時,A的體積分數將 (填“增大”、“減小”或“不變”)。
(4)10 min到15 min的曲線變化的原因可能是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在某一容積為5 L的密閉容器內,加入0.2mol 的CO和0.2mol的H2O(g),在催化劑存在的條件下高溫加熱,發生如下反應:CO(g)+H2O(g) CO2(g)+H2(g),反應放出熱量。反應中CO2的濃度隨時間變化的情況如下圖所示。
CO2(g)+H2(g),反應放出熱量。反應中CO2的濃度隨時間變化的情況如下圖所示。
(1)根據圖中數據,從反應開始至達到平衡時,CO的化學反應速率為________;反應平衡時c(H2)=________。
(2)判斷該反應達到平衡的依據是________(填序號)。
| A.CO減少的化學反應速率和CO2減少的化學反應速率相等 |
| B.CO、H2O、CO2、H2的濃度都相等 |
| C.CO、H2O、CO2、H2的濃度都不再發生變化 |
| D.正、逆反應速率都為零 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
在一固定容積的密閉容器中進行如下反應: 其平衡常數K和溫度,的關系如下:
其平衡常數K和溫度,的關系如下:
(1)該反應的平衡常數K的表達式為___________________。
(2)該反應的正反應為__________(填“吸熱”“放熱”)反應。
(3)能判斷該反應是否已經達到化學平衡狀態的是___________。
A. B.混合氣體中CO濃度不變
B.混合氣體中CO濃度不變
(4)在850℃時,可逆反應:
在該容器內各物質的濃度變化如下: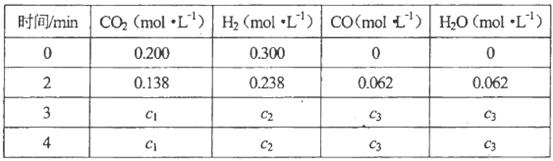
計算:3min~4min達到平衡時,CO的平衡濃度c3=________,CO2(g)的轉化率a=________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)一定條件下,在體積為3 L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
根據題意和所給圖像完成下列各題:
①反應達到平衡時,平衡常數表達式K=________。
②升高溫度,K值________(填“增大”、“減小”或“不變”)。
(2)一定溫度下,將3 mol A氣體和1 mol B氣體通入一密閉容器中,發生如下反應:3A(g)+B(g)??xC(g)。若容器體積固定為2 L,反應2 min時測得剩余0.6 mol B,C的濃度為0.4 mol·L-1。
請填寫下列空白:
①x=________。
②平衡混合物中,C的體積分數為50%,則B的轉化率是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
一定溫度下,向一容積為5 L的恒容密閉容器中充入0.4 mol SO2和0.2 mol O2,發生反應:2SO2(g)+O2(g) 2SO3(g) ΔH="-196" kJ·mol-1。當反應達到平衡時,容器內壓強變為起始時的0.7倍。請回答下列問題:
2SO3(g) ΔH="-196" kJ·mol-1。當反應達到平衡時,容器內壓強變為起始時的0.7倍。請回答下列問題:
(1)判斷該反應達到平衡狀態的標志是 (填字母)。
a.SO2、O2、SO3三者的濃度之比為2∶1∶2
b.容器內氣體的壓強不變
c.容器內混合氣體的密度保持不變
d.SO3的物質的量不再變化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的轉化率為 ;②達到平衡時反應放出的熱量為 ;③此溫度下該反應的平衡常數K= 。
(3)如圖表示平衡時SO2的體積分數隨壓強和溫度變化的曲線,則: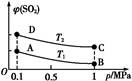
①溫度關系:T1 T2(填“>”、“<”或“=”,下同);
②平衡常數關系:KA KB,KA KD。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
甲醇汽油是由10%一25%的甲醇與其他化工原料、添加劑合成的新型車用燃料,可達到國標汽油的性能和指標。甲醇是一種可再生能源,具有廣泛的開發和應用前景。
Ⅰ、工業上合成甲醇一般采用下列反應:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol,
CH3 OH(g) △H="a" kJ/mol,
下表是該反應在不同溫度下的化學平衡常數(K):
| 溫度/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| 濃度mol/L 時間/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
 CH3 OH(g)△H="a" kJ/mol。恒溫恒容下反應相同時間后,分別測得體系中CO的百分含量分別為w1和w2;已知T1<T2,則
CH3 OH(g)△H="a" kJ/mol。恒溫恒容下反應相同時間后,分別測得體系中CO的百分含量分別為w1和w2;已知T1<T2,則查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com