
【題目】下列分子中,各原子均處于同一平面上的是( )
A.NH3
B.CCl4
C.PCl3
D.CH2O
科目:高中化學 來源: 題型:
【題目】下列性質不是萃取劑所具有的是( )
A. 與原溶劑互不相溶 B. 一定為無機物
C. 與原溶劑不反應 D. 溶質在萃取劑里的溶解度要比在原溶劑中的大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是198K時N2與H2反應過程中能量變化的曲線圖,下列敘述正確的是( ) 
A.該反應的熱化學方程式為N2+3H22NH3△H=﹣92 kJmol﹣1
B.a曲線是加入催化劑時的能量變化曲線
C.加入催化劑,該化學反應的反應熱改變
D.升高溫度,反應速率加快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組通過下列反應原理制備SO2并進行性質探究.反應原理為:Na2SO3(固)+H2SO4(濃)=Na2SO4+SO2↑+H2O 
(1)根據上述原理制備并收集干燥SO2的實驗裝置連接順序為 .
(2)D中盛裝的試劑為 .
(3)甲同學用注射器吸取純凈的SO2并結合裝置G進行SO2的性質實驗,若X是Na2S溶液,其目的是檢驗SO2的 , 可觀察到的現象 .
(4)實驗1:乙同學將溶液X換為濃度均為0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已經除去溶解氧),通入少量SO2后觀察到燒杯產生白色沉淀,乙同學認為白色沉淀為BaSO4 , 為探究白色沉淀的成因,他繼續進行如下實驗驗證:(已知:0.1mol/L Fe(NO3) 3的pH=2)
實驗 | 操作 | 現象 | 結論和解釋 |
2 | 將SO2通入0.1mol/L和BaCl2混合液 | 產生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 將SO2通入和 BaCl2混合液 | 產生白色沉淀 | 酸性條件NO3﹣能將H2SO3氧化為SO42﹣ |
(5)丙同學認為以上實驗只能說明Fe3+和酸性條件下NO3﹣均能將H2SO3氧化為SO42﹣ , 不能說明誰先氧化H2SO3 , 他利用提供的試劑(限選試劑:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)設計實驗方案探究何種微粒先發生反應.請幫助他完成方案(包括操作現象和結論):取乙同學實驗1后裝置G中燒杯的上層清液于試管中, .
(6)丁同學在實驗2過程發現,黃色溶液先變紅棕色后慢慢變淺綠色,查閱資料得:Fe3++6SO2Fe(SO2)63+(紅棕色).請用化學平衡移動原理解釋實驗2中溶液顏色變化的原因 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y是元素周期表ⅦA族的兩種元素。下列敘述能說明X的非金屬性比Y強的是( )
A.X原子的電子層數比Y原子的電子層數多
B.X的含氧酸的酸性比Y的含氧酸的酸性強
C.X的氣態氫化物比Y的氣態氫化物穩定
D.Y的單質能將X從NaX的溶液中置換出來
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:實驗室可供選擇的用于去除氣體雜質的試劑有:濃硫酸、無水氯化鈣、五氧化二磷、堿石灰(主要成分為NaOH和CaO)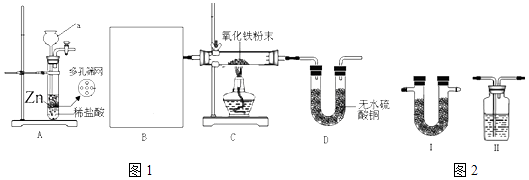
①實驗室用如圖1所示裝置進行純凈干燥的氫氣還原氧化鐵實驗.a裝置名稱為 , 方框B內應選用如圖2裝置(填“Ⅰ”或“Ⅱ”),選用的除雜試劑為(填試劑名稱).
②實驗室常用36.5%濃鹽酸(ρ=1.2gcm﹣3)配制稀鹽酸,若要配制500mL,0.5molL﹣1稀鹽酸,需用量筒取用濃鹽酸mL.
③寫出裝置C中發生反應的化學方程式并用單線橋標明電子的轉移 . 實驗結束時應該采取的操作是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com