
【題目】現在和將來的社會,對能源和材料的需求是越來越大,我們學習化學就為了認識物質,創造物質,開發新能源,發展人類的新未來。請解決以下有關能源的問題:
(1)未來新能源的特點是資源豐富,在使用時對環境無污染或污染很小,且可以再生。下列屬于未來新能源標準的是:________
①天然氣②煤③核能④石油⑤太陽能⑥生物質能⑦風能⑧氫能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
(2)運動會上使用的火炬的燃料一般是丙烷(C3H8),請根據完成下列題目。
①已知11g丙烷(C3H8)在298K和101Kpa條件下完全燃燒生成CO2和液態水時放出的熱量為555kJ,請寫出丙烷燃燒熱的熱化學方程式:_____________;
②以丙烷(C3H8)和空氣為原料,稀硫酸為電解質溶液_____________(填能或不能)設計成池!
若能,則寫出通入丙烷(C3H8)的那一極為:_____________極;氧氣在_____________極發生反應。
若不能,則理由是:_____________。
③丙烷在一定條件下發生脫氫反應可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ·mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ·mol-1
則相同條件下,反應C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_______
(3)已知:H—H鍵的鍵能為436KJ/mol,H—N鍵的鍵能為391KJ/mol,根據化學方程式:N2+3H2![]() 2NH3ΔH=-92.4KJ/mol,
2NH3ΔH=-92.4KJ/mol,
①請計算出N≡N鍵的鍵能為_______________。
②若向處于上述熱化學方程式相同溫度和體積一定的容器中,通入1molN2和3molH2,充分反應后,恢復原溫度時放出的熱量_______________92.4KJ(填大于或小于或等于)。
【答案】
(1)C;
(2)①C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220kJ·mol-1;
②能;負;正;③△H=124.2kJ·mol-1
(3)①945.6KJ/mol;②小于。
【解析】
試題分析:(1)煤、石油、天然氣是化石能源,不是新能源,常見新能源有:太陽能、核能、地熱能、潮汐能、風能、氫能、生物質能等,故選C;
(2)①11g丙烷的物質的量為:![]() =0.25mol,則1mol丙烷完全燃燒放出的熱量為:55kJ ×
=0.25mol,則1mol丙烷完全燃燒放出的熱量為:55kJ × ![]() = 2220kJ,則丙烷燃燒的熱化學方程式為:C3H8(g) + 5O2(g) = 3CO2(g)+4H2O(l) △H=-2220 kJmol-1;
= 2220kJ,則丙烷燃燒的熱化學方程式為:C3H8(g) + 5O2(g) = 3CO2(g)+4H2O(l) △H=-2220 kJmol-1;
②燃料電池中,負極上燃料C3H8或丙烷失電子發生氧化反應,正極上氧化劑得電子發生還原反應,負極電極反應式為C3H8-20e-+10CO32-=13CO2+4H2O,正極反應式為:O2+2CO2+4e-=2CO32-,所以其電池反應式為C3H8+5O2═3CO2+4H2O,放電時,電解質中陰離子移動方向與電流方向相反,則碳酸根離子向負極移動,故答案為:能;負;正;
③已知:①C3H8(g)═CH4(g)+HC≡CH(g)+H2(g) △H1=156.6kJmol-1,
②CH3CH=CH2(g)═CH4(g)+HC≡CH(g) △H2=32.4kJmol-1,
根據蓋斯定律,①-②得C3H8(g)═CH3CH=CH2(g)+H2(g),所以:△H=△H1-△H2=156.6kJmol-1-32.4kJmol-1=124.2kJmol-1,故答案為:124.2kJmol-1;
(3)①已知:H-H鍵能為436kJ/mol,H-N鍵能為391kJ/mol,令N≡N的鍵能為x,對于反應N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,反應熱=反應物的總鍵能-生成物的總鍵能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,解得:x=945.6kJ/mol,故答案為:945.6kJ/mol;
②N2和H2的反應屬于可逆反應,不能完全進行,因此1molN2和3molH2,充分反應后,恢復原溫度時放出的熱量小于92.4KJ,故答案為:小于。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列關于電解質溶液的敘述中正確的是( )
A.Na2CO3、NaHCO3兩種鹽溶液中,離子種類不相同
B.常溫下,1 mol·L-1的CH3COOH溶液與1 mol·L-1的NaOH溶液等體積混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.物質的量濃度相同的NH4Cl和NH4HSO4兩種溶液中,c(NH![]() )前者小于后者
)前者小于后者
D.常溫下,某溶液中由水電離出的c(H+)=10-5 mol·L-1,則此溶液可能是鹽酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設阿伏伽德羅常數的值為NA,下列說法正確的是:
A.0.5mol的NaHSO4固體中含有的陰離子總數為NA
B.0.1mol/L FeCl3的溶液中,含Cl-數目為0.3 NA
C.標準狀況下22.4LNO2氣體與水完全反應時,轉移電子數目為NA
D.常溫常壓下,23gNO2和N2O4的混合氣體中總原子數目為1.5 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從金屬利用的歷史來看,先是青銅器時代,而后是鐵器時代,鋁的利用是近百年的事。這個先后順序跟下列有關的是:
①地殼中的金屬元素的含量;②金屬活動性;③金屬的導電性;④金屬冶煉的難易程度;⑤金屬的延展性;
A. ①③ B. ②⑤ C. ③⑤ D. ②④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是一個化學過程的示意圖。
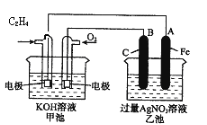
請根據該示意圖完成下列題目:
(1)請問:甲池是________裝置,乙池是________裝置。
(2)在甲池中:通入C2H4的電極名稱是___________,通入O2的電極的電極反應式是________。甲池中發生的反應的化學方程式為:________。
(3)在乙池中:B(石墨)電極的名稱是________,A(Fe)電極的電極反應式為________。
(4)乙池中反應的化學方程式為________。
(5)當乙池中A(Fe)極的質量增加5.40g時,甲池中理論上消耗O2________mL(標準狀況下)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是( )
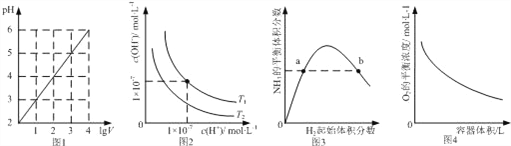
A. 圖1表示1 LpH=2的CH3COOH溶液加水稀釋至V L,pH隨lgV的變化
B. 圖2表示不同溫度下水溶液中H+和OH﹣濃度的變化的曲線,圖中溫度T2>T1
C. 圖3表示一定條件下的合成氨反應中,NH3的平衡體積分數隨H2起始體積分數(N2的起始量恒定)的變化,圖中a點N2的轉化率小于b點
D. 圖4表示同一溫度下,在不同容積的容器中進行反應2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡濃度與容器容積的關系
2BaO(s)+O2(g),O2的平衡濃度與容器容積的關系
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NO很容易與許多分子迅速發生反應,科學家發現在生物體中不斷地產生NO,用于細胞間傳遞信息;NO還參與心血管系統、免疫系統以及中樞和外圍神經系統的調控。
Ⅰ.(1)實驗室用金屬銅和稀硝酸制取NO的離子方程式為
___________________________________________________。
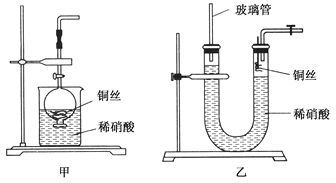
(2)NO是有毒氣體,某學生為防止污染,用分液漏斗和燒杯裝配了一套簡易的、能隨開隨用、隨關隨停的NO氣體發生裝置,如圖甲所示。
①實驗室若沒有銅絲,而只有小銅粒,在使用上述裝置進行實驗時,可用絲狀材料包裹銅粒以代替銅絲進行實驗,這種絲狀材料的成分可以是________(填選項編號)。
A.鐵 B.鋁 C.鉑 D.玻璃
②打開分液漏斗的活塞使反應進行,在分液漏斗中實際看到的氣體是紅棕色的,原因是____________________(填化學方程式)。
(3)為證明銅絲與稀硝酸反應生成的確實是NO,某學生另設計了一套如圖乙所示的裝置制取NO。反就開始后,可以在U形管右端觀察到無色的NO氣體。
①長玻璃管的作用是___________________________________。
②讓反應停止的操作方法及原因是________________________。
(4)以下收集NO氣體的裝置,合理的是________(填選項代號)。
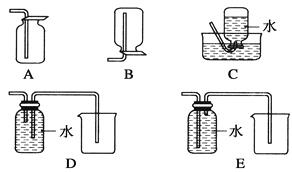
(5)假設實驗中12.8 g Cu全部溶解,需要通入標況下________mL O2才能使NO全部溶于水。
Ⅱ.用金屬銅制取硝酸銅,從節約原料和防止環境污染的角度考慮,下列4種方法中最好的是________(填“甲”、“乙”、“丙”或“丁”),理由是___________________________________________。
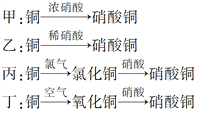
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室模擬合成氨和氨催化氧化的流程如下:

已知實驗室可用飽和亞硝酸鈉(NaNO2)溶液與飽和氯化銨溶液經加熱后反應制取氮氣。
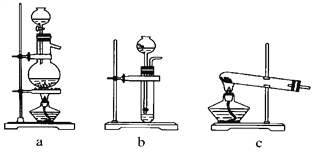
(1)從如圖中選擇制取氣體的合適裝置:氮氣________、氫氣________。
(2)氮氣和氫氣通過甲裝置,甲裝置的作用除了將氣體混合外,還有________、________。

(3)氨合成器出來經冷卻的氣體連續通入乙裝置的水中吸收氨,________(“會”或“不會”)發生倒吸,原因是_________________。
(4)用乙裝置吸收一段時間氨后,再通入空氣,同時將經加熱的鉑絲插入乙裝置的錐形瓶內,能使鉑絲保持紅熱的原因是________,錐形瓶中還可觀察到的現象是____________________________。
(5)寫出乙裝置中氨氧化的化學方程式:_____________________________________________。
(6)反應結束后錐形瓶內的溶液含有H+、OH-、______、________離子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年10月17日,我國成功發射神舟十一號載人飛船,飛船高速進入大氣層后,溫度會迅速升高,其表層的復合材料可保護飛船不受破壞。這體現了該復合材料具有的特點是
A.耐酸性 B.耐熱性 C.耐腐蝕 D.耐堿性
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com