
【題目】關于甲烷與氯氣反應的敘述有
①常溫下,產物一氯甲烷是氣體,其他3種氯代產物都是液體;
②二氯甲烷只有一種的事實證明了甲烷不是平面正方形;
③實驗室可以通過排飽和食鹽水的方法收集甲烷和氯氣;
④如果把收集好甲烷和氯氣的試管放在日光直射的地方,可能會發生爆炸;
⑤光照時,試管中甲烷和氯氣的混合氣體的顏色逐漸變淺,試管壁出現油狀液滴,試管中有少量白霧。其中正確的是
A. ①②③④⑤B. ①②③C. ②③④D. ①②③⑤
 舉一反三期末百分沖刺卷系列答案
舉一反三期末百分沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】使用膽礬(CuSO45H2O)配制0.1mol/L的硫酸銅溶液,正確的操作是( )
A.將膽礬加熱除去結晶水后,稱取16g溶解在1L水中
B.稱取25g膽礬溶于水,然后將此溶液稀釋至1L
C.稱取25g膽礬溶解在1L水里
D.將16g膽礬溶于水,然后將此溶液稀釋至1L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵電池是一種新型可充電電池,與普通高能電池相比,該電池能長時間保持穩定的放電電壓.高鐵電池的總反應為:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.下列敘述不正確的是( )
3Zn(OH)2+2Fe(OH)3+4KOH.下列敘述不正確的是( )
A.放電時負極反應為:Zn﹣2e﹣+2OH﹣═Zn(OH)2
B.放電時正極反應為:FeO ![]() +4H2O+3e﹣═Fe(OH)3+5OH﹣
+4H2O+3e﹣═Fe(OH)3+5OH﹣
C.放電時正極附近溶液的堿性增強
D.放電時每轉移3mol電子,正極有1molK2FeO4被氧化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MnO2是一種重要的無機功能材料,工業上從錳結核中制取純凈的MnO2工藝流程如圖所示: 
部分難溶的電解質溶度積常數(Ksp)如下表:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10﹣17 | 10﹣17 | 10﹣39 |
已知:一定條件下,MnO4﹣可與Mn2+反應生成MnO2
(1)步驟Ⅱ中消耗0.5molMn2+時,用去1molL﹣1的NaClO3溶液200ml,該反應離子方程式為 .
(2)已知溶液B的溶質之一可循環用于上述生產,此物質的名稱是 .
(3)MnO2是堿性鋅錳電池的正極材料.放電過程產生MnOOH,該電池正極的電極反應式是 . 如果維持電流強度為5A,電池工作五分鐘,理論消耗鋅g.(已知F=96500C/mol)
(4)向廢舊鋅錳電池內的混合物(主要成分MnOOH、Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不斷攪拌至無CO2產生為止,寫出MnOOH參與反應的離子方程式 . 向所得溶液中滴加高錳酸鉀溶液產生黑色沉淀,設計實驗證明黑色沉淀成分為MnO2
(5)用廢電池的鋅皮制作ZnSO47H2O的過程中,需除去鋅皮中的少量雜質鐵,其方法是:加入稀H2SO4和H2O2 , 鐵溶解變為Fe3+ , 加堿調節pH為時,鐵剛好沉淀完全(離子濃度小于1×10﹣5molL﹣1時,即可認為該離子沉淀完全).繼續加堿調節pH為時,鋅開始沉淀(假定Zn2+濃度為0.1molL﹣1).若上述過程不加H2O2 , 其后果和原因是
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列為元素周期表中的一部分,用化學式或元素符號回答下列問題:
族 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11種元素中,化學性質最不活潑的是
(2)①②⑤中,最高價氧化物的水化物,堿性最強的物質化學式為 .
(3)①③⑦中形成的簡單離子半徑由大到小的順序是 .
(4)元素⑦的氫化物分子式為 , 用電子式表示該物質的形成過程 .
(5)⑧的最高價氧化物對應的水化物化學式為 . ①和⑨兩元素形成化合物的化學式為 , 該化合物灼燒時焰色為 , 該化合物的溶液與元素⑧的單質反應的離子方程式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外活動小組用如圖裝置進行實驗,試回答下列問題. 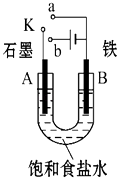
(1)若開始時開關K與a連接,則B極的電極反應式為 .
(2)若開始時開關K與b連接,則B極的電極反應式為 , 總反應的離子方程式為 .
(3)若開關K與b連接,下列說法正確的是(填序號) .
①溶液中Na+向A極移動
②從A極處逸出的氣體能使濕潤的KI淀粉試紙變藍
③反應一段時間后加適量鹽酸可恢復到電解前電解質的濃度
④若標準狀況下B極產生2.24L氣體,則溶液中轉移0.2mol電子
(4)如果模擬工業上離子交換膜法制燒堿的方法,將制得的氫氣、氧氣和氫氧化鉀溶液組合為氫氧燃料電池,則電池正極的電極反應式為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.1L水中溶解了58.5g NaCl,該溶液的物質的量濃度為1mol/L
B.V L Fe2(SO4)3溶液中含a g SO42﹣ , 取此溶液 ![]() ?L用水稀釋成2V L,則稀釋后溶液的c(Fe3+)為
?L用水稀釋成2V L,則稀釋后溶液的c(Fe3+)為 ![]() ?mol/L
?mol/L
C.已知某NaCl溶液的密度是1.17 g/cm3 , 可求出此溶液的物質的量濃度
D.把100mL20%的NaOH溶液跟100mL10%的NaOH 混合后,可判斷NaOH混合溶液的質量分數等于15%
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com