
【題目】實驗室制Cl2反應4HCl(濃)+MnO2 ![]() MnCl2+ Cl2↑+2H2O,下列說法不正確的是
MnCl2+ Cl2↑+2H2O,下列說法不正確的是
A. 還原劑是HCl,氧化劑是MnO2
B. 每有2molHCl被氧化,轉移電子的物質的量為2mol
C. 每消耗1mol MnO2,起還原劑作用的HCl消耗4mol
D. 轉移電子的物質的量為1mol時,生成標準狀況下Cl2的體積為11.2L
【答案】C
【解析】
由4HCl(濃)+MnO2 ![]() MnCl2+ Cl2↑+2H2O可知,HCl中Cl元素的化合價由-1價升高為0,MnO2中Mn元素的化合價由+4價降低為+2價,以此來解答。
MnCl2+ Cl2↑+2H2O可知,HCl中Cl元素的化合價由-1價升高為0,MnO2中Mn元素的化合價由+4價降低為+2價,以此來解答。
A.反應中HCl失電子為還原劑,MnO2得電子為氧化劑,選項A正確;
B.根據化合價的變化可知,反應中Cl元素的化合價由-1價升高到0價,每有2molHCl被氧化,轉移電子的物質的量為2mol,選項B正確;
C.每消耗1mol MnO2,起還原劑作用的HCl消耗2mol,另一部分的HCl起到酸性的作用,選項C不正確;
D.轉移電子的物質的量為1mol時,生成氯氣為0.5mol,標準狀況下Cl2的體積為11.2L,選項D正確;
答案選C。


 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:
【題目】在無色透明溶液中,能大量共存的離子組是( )
A.Mg2+、Na+、SO42﹣
B.K+、H+、HCO3﹣
C.Cu2+、NO3﹣、SO42﹣
D.Ba2+、NO3﹣、CO32﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA代表阿伏加德羅常數,下列物質所含分子數最少的是
A. 6 mol CO2 B. 6g氫氣 C. 標準狀況下,224L氨氣 D. 含氧分子數為4NA的氧氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】含等物質的量NaOH的溶液分別用pH為2和3的CH3COOH溶液中和,設消耗CH3COOH溶液的體積依次為![]() ,則兩者的關系正確的是( )
,則兩者的關系正確的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
【答案】D
【解析】試題分析:醋酸是弱酸,存在電離平衡,稀釋促進電離。所以pH為2和3的CH3COOH溶液的濃度前者大于后者的10倍,所以中和等物質的量的氫氧化鈉消耗醋酸溶液的體積應該是![]() ,答案選D。
,答案選D。
考點:考查弱電解質的電離以及外界條件對電離平衡的影響
點評:該題是高考中的常見題型,屬于中等難度的試題。試題綜合性強,在注重對學生基礎知識的鞏固和訓練的同時,側重對學生能力的培養和方法的指導與訓練,有利于培養學生的邏輯推理能力和抽象思維能力。
【題型】單選題
【結束】
22
【題目】某烷烴的各種同分異構體中,主鏈上有4個碳原子的只有兩種結構,則含有相同碳原子數且主鏈上也有4個碳原子的烯烴(只含一個碳碳雙鍵)的同分異構體有( )
A. 2種 B. 3種 C. 4種 D. 5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸亞鉻水合物[Cr(CH3COO)2]2·2H2O是一種氧氣吸收劑,為紅棕色晶體,易被氧化,微溶于乙醇,不溶于水和乙醚(易揮發的有機溶劑)。其制備裝置及步驟如下:

①檢查裝置氣密性,往三頸燒瓶中依次加入過量鋅粉、適量CrCl3溶液。
②關閉k2打開k1,旋開分液漏斗的旋塞并控制好滴速。
③待三頸燒瓶內的溶液由深綠色(Cr3+)變為亮藍色(Cr2+)時,把溶液轉移到裝置乙中,當出現大量紅棕色晶體時,關閉分液漏斗的旋塞。
④將裝置乙中混合物快速過濾、洗滌和干燥,稱量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)裝置甲中連通管a的作用是______________________。
(2)三頸燒瓶中的Zn除了與鹽酸生成H2外,發生的另一個反應的離子方程式為______________________。
(3)實驗步驟③中溶液自動轉移至裝置乙中的實驗操作為______________________。
(4)裝置丙中導管口水封的目的是______________________。
(5)洗滌產品時,為了去除可溶性雜質和水分,下列試劑的正確使用順序是________(填字母)。
a.乙醚 b.去氧冷的蒸餾水 c.無水乙醇
(6)若實驗所取用的CrCl3溶液中含溶質3.17 g,則[Cr(CH3COO)2]2·2H2O(相對分子質量為376)的產率是______________________。
(7)一定條件下,[Cr(CH3COO)2]2·2H2O受熱得到CO和CO2的混合氣體,請設計實驗檢驗這兩種氣體的存在________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎢是我國豐產元素,是熔點最高的金屬,廣泛用于拉制燈泡的燈絲, 有“光明使者”的美譽。鎢在自然界主要以鎢 (+6價) 酸鹽的形式存在。有開采價值的鎢礦石是白鎢礦和黑鎢礦。白鎢礦的主要成分是鎢酸鈣(CaWO4);黑鎢礦的主要成分是鐵和錳的鎢酸鹽,化學式常寫成(FeWO4和MnWO4),鎢酸(H2WO4)酸性很弱,難溶于水。
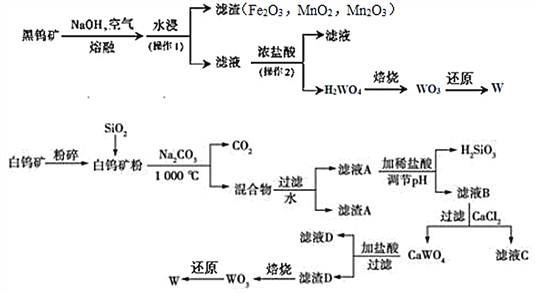
已知:①CaWO4與碳酸鈉共熱發生復分解反應。
②鎢在高溫下可與焦炭(C)反應生成硬質合金碳化鎢(WC)。
(1)74W在周期表的位置是第_______周期。
(2)寫出黑鎢礦中FeWO4與氫氧化鈉,空氣熔融時的化學反應方程式________________________________;白鎢礦粉與碳酸鈉共熱的化學反應方程式_______________。
(3)工業上,可用一氧化碳、氫氣或鋁還原WO3冶煉W。理論上,等物質的量的CO、H2、Al作還原劑,可得到W的質量之比為______。用焦炭也能還原WO3,但用氫氣更具有優點,其理由是_____________________________________。
(4)已知氫氧化鈣和鎢酸鈣(CaWO4)都是微溶電解質,兩者的溶解度均隨溫度升高而減小。下圖為不同溫度下Ca(OH)2、CaWO4的沉淀溶解平衡曲線,則T1時Ksp(CaWO4)=_________(mol/L)2。將鎢酸鈉溶液加入石灰乳得到大量鎢酸鈣,發生反應的離子方程式為_____________________________,T2時該反應的平衡常數為__________。

(5)工業上,可用電解法從碳化鎢廢料中回收鎢。碳化鎢作陽極,不銹鋼作陰極,鹽酸為電解質溶液,陽極析出濾渣D并放出CO2。寫出陽極的電極反應式_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置進行相應實驗,能達到實驗目的的是
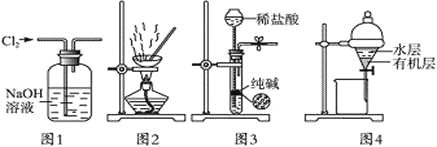
A. 用圖1所示裝置除去Cl2中含有的少量HCl
B. 用圖2所示裝置蒸干NH4Cl飽和溶液制備NH4Cl晶體
C. 用圖3所示裝置制取少量純凈的CO2氣體
D. 用圖4所示裝置分離CCl4萃取碘水后已分層的有機層和水層
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數,下列說法正確的是
A. CO的摩爾質量為28g
B. 1mol·L-1 NaOH溶液中所含有Na+數目為NA
C. 8g NH4NO3中含有0.2mol N原子
D. 0.5mol H2所占的體積約為11.2L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) 在一密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是( )
A.增加Fe(s)的量
B.將容器的體積縮小一半
C.升高溫度
D.通入水蒸氣
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com