
【題目】磷元素生產和生活中有廣泛的應用。
(1)P原子價電子排布圖為____。
(2)四(三苯基磷)鈀分子結構如圖1。

P原子以正四面體的形態圍繞在鈀原子中心上,判斷該物質在水中溶解度并加以解釋:_________。該物質可用于圖2所示物質A的合成,物質A中碳原子雜化軌道類型為____;一個A分子中手性碳原子數目為____。
(3)在圖3中表示出四(三苯基磷)鈀分子中配位鍵____。

(4)PCl5是一種白色晶體,在恒容密閉容器中加熱可在148℃液化,形成一種能導電的熔體,測得其中含有一種正四面體形陽離子和一種正六面體形陰離子,熔體中P-Cl的鍵長只有198nm和206nm兩種,這兩種離子的化學式為____;正四面體形陽離子中鍵角大于PCl3的鍵角原因為_____。
(5)磷有三種含氧酸H3PO2、H3PO3、H3PO4,其中磷元素均以sp3雜化與相鄰原子形成四個σ鍵,則H3PO3的結構式是________,寫出H3PO2與足量氫氧化鈉溶液反應的化學方程式:____________________。磷的三種含氧酸H3PO2、H3PO3、H3PO4的酸性強弱順序為H3PO2<H3PO3<H3PO4,其原因是_____________________。
(6)磷化硼是一種受到高度關注的耐磨涂料,它可用作金屬的表面保護層。磷化硼可由三溴化硼和三溴化磷在氫氣中高溫反應合成。
①寫出合成磷化硼的化學反應方程式:____________________
②三溴化硼分子和三溴化磷分子的立體構型分別是________、________。
【答案】 ![]() 不易溶于水,水為極性分子,四(三苯基膦)鈀分子為非極性分子,分子極性不相似,故不相溶 sp、sp2、sp3 3
不易溶于水,水為極性分子,四(三苯基膦)鈀分子為非極性分子,分子極性不相似,故不相溶 sp、sp2、sp3 3 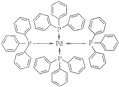 PCl4+和PCl6- P原子沒有孤電子對,孤電子對對成鍵電子的排斥力大于成鍵電子對間的排斥力
PCl4+和PCl6- P原子沒有孤電子對,孤電子對對成鍵電子的排斥力大于成鍵電子對間的排斥力  NaOH+H3PO2===NaH2PO2+H2O H3PO2、H3PO3、H3PO4中磷元素的化合價依次為+1、+3和+5價,中心磷原子的正電荷依次升高,導致P—O—H中氧原子的電子更易向P原子偏移,因而H3PO2→H3PO3→H3PO4越來越易電離出氫離子,酸性越來越強 BBr3+PBr3+3H2
NaOH+H3PO2===NaH2PO2+H2O H3PO2、H3PO3、H3PO4中磷元素的化合價依次為+1、+3和+5價,中心磷原子的正電荷依次升高,導致P—O—H中氧原子的電子更易向P原子偏移,因而H3PO2→H3PO3→H3PO4越來越易電離出氫離子,酸性越來越強 BBr3+PBr3+3H2![]() BP+6HBr 平面三角形 三角錐形
BP+6HBr 平面三角形 三角錐形
【解析】(1)考查價電子以及排布圖的書寫,P屬于主族元素,P的價電子指最外層電子,價電子排布圖為![]() ;(2)考查分子的溶解度和雜化類型的判斷,水分子是極性分子,四(三苯基磷)鈀空間構型為正四面體,屬于非極性分子,根據相似相溶,因此四(三苯基磷)鈀不溶于水;碳碳雙鍵中有3個σ鍵,無孤電子對,因此是sp2雜化,甲基、亞甲基等中的碳原子有4個σ鍵,無孤電子對,是sp3雜化,碳碳叁鍵上的碳原子有2個σ鍵,無孤電子對,是sp雜化;手性碳原子是連有四個不同的原子或原子團的碳原子,根據結構簡式,1分子A中含有3個手性碳原子;(3)考查配位鍵,P最外層有5個電子,能形成3個共價鍵,根據結構,屬于配位鍵的是
;(2)考查分子的溶解度和雜化類型的判斷,水分子是極性分子,四(三苯基磷)鈀空間構型為正四面體,屬于非極性分子,根據相似相溶,因此四(三苯基磷)鈀不溶于水;碳碳雙鍵中有3個σ鍵,無孤電子對,因此是sp2雜化,甲基、亞甲基等中的碳原子有4個σ鍵,無孤電子對,是sp3雜化,碳碳叁鍵上的碳原子有2個σ鍵,無孤電子對,是sp雜化;手性碳原子是連有四個不同的原子或原子團的碳原子,根據結構簡式,1分子A中含有3個手性碳原子;(3)考查配位鍵,P最外層有5個電子,能形成3個共價鍵,根據結構,屬于配位鍵的是 ;(4)本題考查孤電子對的計算,因為形成一種是正四面體的陽離子和一種是正六面體形的陰離子,且P-Cl只有兩種鍵長,因此為PCl4+和PCl6-,PCl4+中中性原子P含有孤電子對數為(5-1-4)/2=0,PCl3中中性原子O含有孤電子對數為(5-3)/2=1,孤電子對與成鍵電子對之間的斥力大于成鍵電子對之間的斥力,因此PCl4+的鍵角大于PCl3;(5)本題考查含氧酸,含氧酸中的氫原子一種是與中性原子直接相連,一種與氧構成羥基,含氧酸電離出的H+是由羥基上的氫電離產生,如果H3PO3是三元酸,則中性P有三個羥基,無孤電子對,應是sp2雜化,不符合信息,應是2個羥基,即結構式為
;(4)本題考查孤電子對的計算,因為形成一種是正四面體的陽離子和一種是正六面體形的陰離子,且P-Cl只有兩種鍵長,因此為PCl4+和PCl6-,PCl4+中中性原子P含有孤電子對數為(5-1-4)/2=0,PCl3中中性原子O含有孤電子對數為(5-3)/2=1,孤電子對與成鍵電子對之間的斥力大于成鍵電子對之間的斥力,因此PCl4+的鍵角大于PCl3;(5)本題考查含氧酸,含氧酸中的氫原子一種是與中性原子直接相連,一種與氧構成羥基,含氧酸電離出的H+是由羥基上的氫電離產生,如果H3PO3是三元酸,則中性P有三個羥基,無孤電子對,應是sp2雜化,不符合信息,應是2個羥基,即結構式為 ,根據上述分析,H3PO2有1個羥基,屬于一元酸,與氫氧化鈉反應的方程式為H3PO2+NaOH=NaH2PO2+H2O,H3PO4中含有三個羥基,可以寫成(HO)nPOm,三種含氧酸的化合價依次為+1、+3、+5價,中性P原子的正電荷依次升高,使得P-O-H中氧原子的電子移向P原子,越容易電離出H+,即酸性越強;(6)①根據信息,得出反應方程式為BBr3+PBr3+3H2
,根據上述分析,H3PO2有1個羥基,屬于一元酸,與氫氧化鈉反應的方程式為H3PO2+NaOH=NaH2PO2+H2O,H3PO4中含有三個羥基,可以寫成(HO)nPOm,三種含氧酸的化合價依次為+1、+3、+5價,中性P原子的正電荷依次升高,使得P-O-H中氧原子的電子移向P原子,越容易電離出H+,即酸性越強;(6)①根據信息,得出反應方程式為BBr3+PBr3+3H2![]() BP+6HBr;三溴化硼中中性原子是B,含有3個σ鍵,孤電子對數(3-3)/2=0,因此價層電子對數為3,空間構型平面三角形,三溴化磷中性原子為P,有3個σ鍵,孤電子對數為(5-3)/2=1,空間構型為三角錐形。
BP+6HBr;三溴化硼中中性原子是B,含有3個σ鍵,孤電子對數(3-3)/2=0,因此價層電子對數為3,空間構型平面三角形,三溴化磷中性原子為P,有3個σ鍵,孤電子對數為(5-3)/2=1,空間構型為三角錐形。


科目:高中化學 來源: 題型:
【題目】化學與生產、生活、技術密切關。下列說法錯誤的是
A. 某些疫苗等生物制劑要冷凍保存是為了防止蛋白質變性
B. 活性鐵粉在食品袋中作“去氧劑”表現的是鐵粉的還原性
C. 可在元素周期表中金屬與非金屬的分界處尋找催化劑和耐高溫、耐腐蝕的合金材料
D. 用酚醛樹脂為基體合成的增強塑料是復合材料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《化學反應原理》模塊試題
(1)已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0。某溫度下,將一定量的N2和H2的混合氣體充入1L的密閉容器中,充分反應后達到平衡。請回答:
2NH3(g) △H<0。某溫度下,將一定量的N2和H2的混合氣體充入1L的密閉容器中,充分反應后達到平衡。請回答:
①若N2、H2的反應速率分別用v(N2)、v(H2)表示,則v(N2) ∶v(H2)=_______________。
②若保持其他條件不變,升高溫度,平衡________________(填“向正反應方向移動”、“向逆反應方向移動”或“不移動”),化學平衡常數________________(填“增大”、“減小”或“不變”)
(2)根據水溶液中離子平衡的相關知識,回答下列問題:
①鋁鹽、鐵鹽可作凈水劑。鐵鹽作凈水劑的原因是_____________(用離子方程式表示)
②常溫下,檸檬水的pH為3,則溶液中c(OH-)為_______________。
③向稀醋酸雜中滴加NaOH溶液至中性,此時溶液中c(CH3COO-) _____c(Na+)(填“大于”“小于”或“等于”。)
④常溫下,向1 mLAgCl飽和溶液中分別加入等體積的以下三種溶液,析出AgCl固體最多的是___________(填字母)。
A.0.1mol/LNaCl B.0.lmol/LMgCl2 C.0.1.mol/L AlCl3
(3)研究化學能與其他能量的轉化對生產和生活活有重要意義。請回答:
①一氧化碳是水煤氣的主要成分之—,其燃燒熱為283.0kJ/mol,則一氧化碳燃燒的熱化學方程式為_____________________________________。
②電解法精煉粗銅時,_____________________作陽極 。
③下圖所示裝置中鹽橋的作用是__________________(填字母)
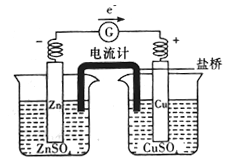
A.使電子通過
B.使兩個燒杯中的溶液連成—個通路
C.使ZnSO4溶液和CuSO4溶液均保持電中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各種物質既能與強酸反應,又能與強堿反應的是( )
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3
A. ①③⑤ B. ②③④ C. ①③④ D. ①④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 某外圍電子排布為4f75d16s2基態原子,該元素位于周期表中第六周期第ⅢB族
B. 在元素周期表中,s區,d區和ds區的元素都是金屬元素
C. 當碳原子的核外電子排布由![]() 轉變為
轉變為![]() 時,釋放能量,由激發態轉化成基態
時,釋放能量,由激發態轉化成基態
D. 非金屬元素形成的共價化合物中,原子的最外層電子數不一定是2或8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可由乙苯(C8H10)生產苯乙烯(C8H8),其反應原理是:![]() 下列說法中錯誤的是
下列說法中錯誤的是
A. 可用溴的四氯化碳來鑒別乙苯和苯乙烯
B. 乙苯分子中所有原子可能都處于同一平面
C. 苯乙烯可發生氧化反應、取代反應、加成反應
D. 乙苯與苯互為同系物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值。下列說法正確的是
A. 在7.8gNa2O2固體中,含有陰、陽離子的總數為0.3NA
B. 光照下,將16gCH4和71gCl2組成的混合氣體充分反應,生成CH3Cl分子數為NA
C. 若發生水解的Fe3+為1mol,此時生成的氫氧化鐵膠粒數為NA
D. 100g質量分數為46%的乙醇水溶液中,所含氫原子總數為6NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com