
(12分)乙醚極易揮發、微溶于水、是良好的有機溶劑。乙醇與濃硫酸的混合物在不同溫度下反應能生成乙烯或乙醚。某實驗小組用下圖裝置制取乙醚和乙烯。
1.制乙醚:在蒸餾燒瓶中先加入10 mL乙醇,慢慢加入10 mL濃硫酸,冷卻,固定裝置。加熱到140℃時,打開分液漏斗活塞,繼續滴加10 mL乙醇,并保持140℃,此時燒瓶c中收集到無色液體。
(1)Ⅰ和Ⅱ是反應發生裝置,應該選擇 (選答“Ⅰ”或“Ⅱ”)與裝置Ⅲ相連。
(2)乙醇通過分液漏斗下端連接的長導管插入到液面下加入,目的有二,一是使反應物充分混合,二是
。
2.Ⅲ中水冷凝管的進水口是 (選答“a”或“b”)。冰鹽水的作用是 。
3.有同學認為以上裝置還不夠完善,一是溴水可能倒吸,二是尾氣彌漫在空氣中遇明火危險。該同學設
計了以下幾種裝置與導管d連接,你認為合理的是(選填編號) 。
4.反應一段時間后,升溫到170℃,觀察到反應物變為黑色,溴水褪色。寫出實驗過程中有氣體生成化學方程式(寫兩個方程式) ; 。
5.實驗中收集到的乙醚產品中可能含有多種雜質。某同學設計了以下提純方案:
(1)分液步驟除去產品中的酸性雜質,則X可以是 。
(2)蒸餾操作可除去的雜質是 。
(12分)
1.(1)I (2)防止乙醇揮發(各1分)
2.b 冷凝液化乙醚(各1分)
3.c、d(2分)
4. CH3CH2OH+4H2SO4(濃) △ C+CO2↑+4SO2↑+7H2O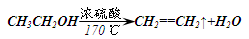
5.(1)NaOH溶液 (1分) (2)乙醇 (1分)
解析試題分析:1、(1)控制反應溫度為140℃,溫度計應放在反應液中,故選Ⅰ;(2)把乙醇直接加入溶液中,乙醇溶于有機溶劑,減少乙醇的揮發;2、冷凝管的水從下口進,上口出,逆流冷凝效果好;根據乙醇和乙醚的沸點,用冰鹽水可將乙醚冷凝;3、用溴水吸收乙烯,還要防倒吸,排除a、b,a中不能將溴乙烷和乙醚分離開來,b不能防倒吸,故選c,d;4、乙醇和濃硫酸在一定的溫度下發生消去反應生成乙烯,濃硫酸會將乙醇氧化為二氧化碳或是碳單質等;5、(1)和酸性物質可以反應的是堿液,故選氫氧化鈉溶液;(2)蒸餾可以將沸點不同的物質進行分離,故可將乙醇分離出來。
考點:考查制取乙醚實驗中溫度計的作用、混合物的分離方法、冷凝管的使用方法、有機方程式的書寫等知識。


科目:高中化學 來源: 題型:單選題
下列實驗方案不可行或結論不正確的是
① 用酸性高錳酸鉀溶液除去乙烷氣體中的少量乙烯
② 將溴乙烷和NaOH溶液混合加熱后,再加入硝酸銀溶液,檢驗溴元素
③ 分液時,分液漏斗里下層液體從下口放出,上層液體從上口倒出
④ 向同pH、同體積的醋酸和鹽酸溶液中加入足量鎂粉至完全反應,通過比較產生H2的體積判斷兩種酸的電離程度:醋酸<鹽酸
⑤ 向新制的AgCl乳白色懸濁液中滴加0.1 mol/L的KI溶液,產生黃色沉淀,證明:Ksp[AgCl]>Ksp[AgI]
| A.①② | B.①③⑤ | C.②④ | D.③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:問答題
【化學與技術】
將磷肥生產中形成的副產物石膏(CaSO4·2H2O)轉化為硫酸鉀肥料和氯化鈣水合物儲熱材料,無論從經濟效益、資源綜合利用還是從環境保護角度看都具有重要意義。以下是石膏轉化為硫酸鉀和氯化鈣的工藝流程示意圖。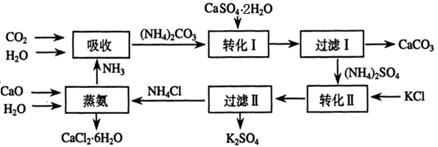
(1)本工藝中所用的原料除CaSO4·2H2O、KCl外,還需要 等原料。
(2)石膏懸濁液中加入碳酸銨溶液后發生反應的離子方程式為 。
(3)過濾Ⅰ操作所得固體中,除CaCO3外還含有 (填化學式)等物質,該固體可用作生產水泥的原料。
(4)檢驗過濾Ⅰ所得濾液中含有CO32-的方法是 。
(5)氯化鈣結晶水合物(CaCl2·6H2O)是目前常用的無機儲熱材料,選擇的依據是 。
a.熔點較低(29℃熔化) b.能導電 c.能制冷 d.無毒
(6)上述工藝流程中體現綠色化學理念的是 。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(13分)硫代硫酸鈉是一種重要的化工產品。某興趣小組擬制備硫代硫酸鈉晶體(Na2S2O3·5H2O)。
I.[查閱資料]
(1)Na2S2O3·5H2O是無色透明晶體,易溶于水。其稀溶液與BaCl2溶液混合無沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得產品中常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3難溶于水,可溶于稀HCl。
Ⅱ.[制備產品]
實驗裝置如圖所示(省略夾持裝置)
實驗步驟:
(1)檢查裝置氣密性,按圖示加入試劑。儀器a的名稱是____;E中的試劑是___(選填下列字母編號)。
A.稀H2SO4 B.NaOH溶液 C.飽和NaHSO3溶液
(2)先向C中燒瓶加入Na2S和Na2CO3混合溶液,再向A中燒瓶滴加濃H2SO4。
(3)待Na2S和Na2CO3完全消耗后,結束反應。過濾C中混合液,濾液經____(填寫操作名稱)、結晶、過濾、洗滌、干燥、得到產品。
Ⅲ.[探究與反思]
(1)為驗證產品中含有Na2SO3和Na2SO4,該小組設計了以下實驗方案,請將方案補充完整。(所需試劑從稀HNO3、稀H2SO4、稀HCl、蒸餾水中選擇)
取適量產品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____,若沉淀未完全溶解,并有刺激性氣味的氣體產生,則可確定產品中含有Na2SO3和Na2SO4。
(2)為減少裝置C中生成的Na2SO4的量,在不改變原有裝置的基礎上對原有實驗步驟(2)進行了改進,改進后的操作是_______。
(3)Na2S2O3·5H2O的溶解度隨溫度升高顯著增大,所得產品通過_____方法提純。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(15分)高氯酸銅[Cu(ClO4)2·6H2O]易溶于水,120 ℃開始分解,常用于生產電極和作催化劑等。可由氯化銅通過下列反應制備:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易揮發的發煙液體,溫度高于130 ℃易爆炸。下表列出相應金屬離子生成氫氧化物沉淀的pH(開始沉淀的pH按金屬離子濃度為1 mol·L-1):
| 金屬離子 | 開始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
(15 分)
苯乙酸銅是合成優良催化劑、傳感材料——納米氧化銅的重要前驅體之一。下面是它的一種實驗室合成路線:
制備苯乙酸的裝置示意圖如下(加熱和夾持裝置等略):
已知:苯乙酸的熔點為76.5 ℃,微溶于冷水,溶于乙醇。
回答下列問題:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸時,加入蒸餾水與濃硫酸的先后順序是
。
(2)將a中的溶液加熱至100 ℃,緩緩滴加40 g苯乙腈到硫酸溶液中,然后升溫至130 ℃繼續反應。在裝置中,儀器b的作用是 ;儀器c的名稱是 ,其作用是 。
反應結束后加適量冷水,再分離出苯乙酸粗品。加人冷水的目的是 。下列儀器中可用于分離苯乙酸粗品的是 (填標號)。
| A.分液漏斗 | B.漏斗 | C.燒杯 | D.直形冷凝管E.玻璃棒 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
氨基甲酸銨是一種用途廣泛的化工原料。有關它的資料如下:①常溫下,在干燥的空氣中穩定,遇水或潮濕空氣則生成碳酸銨或碳酸氫銨;②熔點58℃,59℃則可分解成NH3和CO2氣體;③在密封管內加熱至120℃~140℃時失水生成尿素[CO(NH2)2];④酸性溶液中迅速分解;⑤合成氨基甲酸銨原理為:

(1)寫出氨基甲酸銨在密封管內加熱至120°C~140°C生成尿素的反應方程式:_______________
(2)儀器B名稱________;盛放藥品是: ________;
(3)合成氨基甲酸銨的反應在一定條件下能自發進行,該反應的反應熱ΔH_____0(填“>” “=”或“<”)
(4)有同學建議該CO2發生裝置直接改用“干冰”,你認為他的改進有何優點:(回答二點)
①________________;②________________
(5)該實驗裝置中有明顯導致實驗失敗的隱患有:(指出主要二處)
①________________;②________________
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
K3[Fe(C2O4)3]·3H2O [三草酸合鐵(Ⅲ)酸鉀晶體]易溶于水,難溶于乙醇,可作為有機反應的催化劑。實驗室可用鐵屑為原料制備,相關反應過程如下,請回下列問題: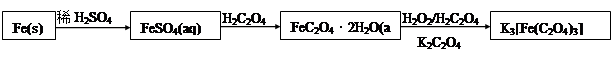
(1)鐵屑中常含硫元素,因而在制備FeSO4時會產生有毒的H2S氣體,該氣體可用氫氧化鈉溶液吸收。下列吸收裝置正確的是 。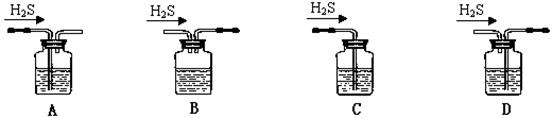
(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶體中所含結晶水可通過重量分析法測定,主要步驟有:①稱量,②置于烘箱中脫結晶水,③冷卻,④稱量,⑤重復②~④至恒重,⑥計算。
步驟③需要在干燥器中進行的原因是 ;
步驟⑤的目的是 。
(4)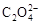 可被酸性KMnO4溶液氧化放出CO2氣體,所以實驗產物中K3[Fe(C2O4)3]·3H2O含量測定可用KMnO4標準溶液滴定。
可被酸性KMnO4溶液氧化放出CO2氣體,所以實驗產物中K3[Fe(C2O4)3]·3H2O含量測定可用KMnO4標準溶液滴定。
①寫出滴定過程中發生反應的離子方程式 ;
②下列滴定操作中使滴定結果偏高的是 ;
| A.滴定管用蒸餾水洗滌后,立即裝入標準液 |
| B.錐形瓶在裝待測液前未用待測液潤洗 |
| C.滴定前滴定管尖嘴處有氣泡,滴定后氣泡消失 |
| D.讀取標準液體積時,滴定前仰視讀數,滴定后俯視讀數 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
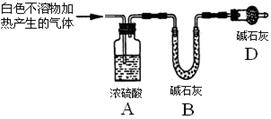
資料顯示:鎂與飽和碳酸氫鈉溶液反應產生大量氣體和白色不溶物。某同學設計了如下實驗方案并驗證產物、探究反應原理。
(1)提出假設
實驗I:用砂紙擦去鎂條表面氧化膜,將其放入盛有適量滴有酚酞的飽和碳酸氫鈉溶液的試管中,迅速反應,產生大量氣泡和白色不溶物,溶液由淺紅變紅。
該同學對反應中產生的白色不溶物做出如下猜測:
猜測1:白色不溶物可能為 。
猜測2:白色不溶物可能為MgCO3。
猜測3:白色不溶物可能是堿式碳酸鎂[xMgCO3·yMg(OH)2]。
(2)設計定性實驗確定產物并驗證猜測:
| 實驗序號 | 實驗 | 實驗現象 | 結論 |
| 實驗Ⅱ | 將實驗I中收集到的氣體點燃 | 能安靜燃燒、產生淡藍色火焰 | 氣體成分為 _? _ |
| 實驗Ⅲ | 取實驗I中的白色不溶物,洗滌, 加入足量? | ? | 白色不溶物可能含有MgCO3 |
| 實驗Ⅳ | 取實驗I中的澄清液,向其中加入少量CaCl2稀溶液 | 產生白色沉淀 | 溶液中存在 ④ 離子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com