
【題目】某廠排出的廢液主要含有硝酸鋅和硝酸銀,為了從中回收金屬銀和硝酸鋅,某中學化學課外活動小組設計了以下的實驗步驟:

(1)X是____________,Y是____________ (寫化學式,下同)。
(2)固體A、濾液B、C的主要成分:A______________,B______________,C______________。
(3)Z處進行的操作是__________________________。
【答案】Zn H2SO4 Zn和Ag Zn(NO3)2 ZnSO4 先過濾,再將濾液蒸發結晶
【解析】
實驗的目的是回收金屬銀和硝酸鋅,因此第一步應向混合溶液中加入足量的鋅來置換出銀,由于鋅過量,因此固體A是鋅和銀的混合物,利用金屬活動性的差異可以溶解鋅而得到純凈的銀,結合濾液C中加入適量的硝酸鋇溶液可得液體B,可知Y應為稀硫酸。
(1)我們向廢液中加入過量的鋅,讓鋅與硝酸銀反應 Zn+2AgNO3=2Ag+Zn(NO3)2然后過濾,得到固體A(Zn和 Ag)和液體B Zn(NO3)2溶液,為了把固體A中的銀和鋅分開,我們可以加入過量的Y即稀硫酸溶液,故X、Y的化學式:X:Zn,Y:H2SO4;
(2)固體A中加入過量Y即稀硫酸溶液后,其中鋅與稀硫酸反應會生成硫酸鋅,故濾液C為硫酸鋅溶液,故固體A和濾液B、C中主要成分的化學式:A:Ag,Zn;B:Zn(NO3)2;C:ZnSO4;
(3)液體B為Zn(NO3)2溶液,要想得到硝酸鋅固體,我們可以對溶液進行加熱蒸發,故Z處進行的操作是先過濾,再將濾液蒸發結晶;
故答案為:
(1)X:Zn;Y:H2SO4
(2)A:Ag,Zn;B:Zn(NO3)2;C:ZnSO4;
(3)先過濾,再將濾液蒸發結晶。


科目:高中化學 來源: 題型:
【題目】反應2A(g)2B(g)+C(g)△H>0,達到平衡時,要使逆反應速率降低,A的濃度增大,應采取的措施是( )
A.減壓
B.降溫
C.加壓
D.增大B的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用溴和苯反應制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸餾;②水洗;③用干燥劑干燥;④10% NaOH溶液洗;⑤水洗;⑥分液。正確的操作順序是( )
A.②⑥④⑥⑤⑥③①B.①②⑥③④⑤
C.④⑥②⑥③①⑤D.②⑥④⑥①⑤③
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中,可達到對應實驗目的的是( )
實驗操作 | 實驗目的 | |
A | 苯和溴水混合后加入鐵粉 | 制溴苯 |
B | 某有機物與溴的四氯化碳溶液混合 | 確認該有機物含碳碳雙鍵 |
C | 將 | 檢驗該有機物中的溴原子 |
D | 乙醇與酸性高錳酸鉀溶液混合 | 檢驗乙醇具有還原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在室溫下,同種規格的鋁片分別與下列物質混合,化學反應速率最大的是( )
A.0.1mol/L的鹽酸15mL
B.0.2mol/L的鹽酸12mL
C.0.25mol/L的鹽酸8mL
D.18mol/L的硫酸15mL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知0.05mol某烴在足量的空氣中完全燃燒若將產物通入足量的澄清石灰水,得到白色沉淀30.0g若用足量的堿石灰吸收燃燒產物,增重18.6g,則該烴的實驗式為___________,;分子式為_______;
若該烴分子中所有碳原子都在一個平面上,其結構簡式為________________________
(2)某有機物經李比希法和質譜法分析得知其相對分子質量為136,分子式C8H8O2。分子中只含一個苯環且苯環上只有一個取代基,其核磁共振氫譜如圖,則A可能的結構簡式_____________________

(3)某烴的含氧衍生物,其分子量小于150,其中含氧元素的質量分數為50%,則其分子中的氧原子個數可能為____________,含氧原子數最多的該有機物的分子式為____________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.25℃時在25 mL氫氧化鈉溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲線如下圖所示.下列說法正確的是__________________
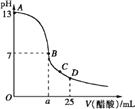
A.滴定終點時俯視讀數則測定的氫氧化鈉濃度偏高
B.B、C、D三點的溶液中水的電離程度為B>C>D
C.D點,c(CH3COO-)+ c(CH3COOH)>2c(Na+)
D.B點為滴定終點
E.B點時c(CH3COO-)=c(Na+)
F. 若由體積相等的氫氧化鈉和醋酸溶液混合而且恰好呈中性,則混合前c(NaOH)< c(CH3COOH)
G.滴定前的氫氧化鈉溶液的濃度為0.1mol/L
Ⅱ.(1)為了檢驗某殘留物中鐵元素的含量,先將殘留物預處理,把鐵元素還原成Fe2+,再用KMnO4標準溶液在酸性條件下進行氧化還原滴定,寫出滴定過程中反應的離子方程式:________________________________________KMnO4應裝在___________滴定管中(填“酸式”或“堿式”)滴定前是否要滴加指示劑?___(填“是”或“否”),滴定終點的判斷方法:_____________________________
(2)某酸性CuCl2溶液中含少量的FeCl3,為制得純凈CuCl2溶液,宜加入______________調至溶液pH=4,使Fe3+轉化為Fe(OH)3沉淀,此時溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2018年大部分地區爆發了流感流感常伴隨發熱高燒等癥狀。布洛芬是一種常用的兒童退熱藥,它的BHC合成法如下
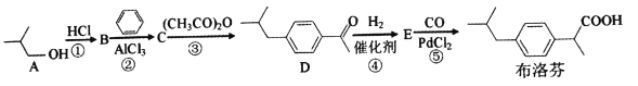
(1)A的名稱是__________,B的核磁共振氫譜有__________種吸收峰。
(2)①反應需用濃鹽酸而不用稀鹽酸,其原因是______________________________。
(3)E的分子式是__________,官能團的名稱是__________。
(4)③反應的化學方程式是____________________,反應類型是__________。
(5)滿足下列條件的布洛芬的同分異構體有__________種
a遇FeCl3溶液顯紫色 b.分子中有5種不同化學環境的氫 c.能發生銀鏡反應
(6)請寫出由苯和( CH3COOCH2CO)2O為原料合成![]() 的線路圖(其他試劑任選)___________
的線路圖(其他試劑任選)___________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com