
【題目】用NA表示阿伏加德羅常數的值,下列敘述中正確的是
A. 1 mol甲基(-CH3)所含的電子數為10NA
B. 常溫常壓下,1 mol分子式為C2H6O的有機物中,含有C-O鍵的數目為NA
C. 14g由乙烯和環丙烷(![]() )組成的混合氣體中,含有的原子總數為3NA
)組成的混合氣體中,含有的原子總數為3NA
D. 標準狀況下,22.4L四氯化碳中含有共用電子對的數目為4NA
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】某小組研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,將渾濁液均分為2份,進行如下實驗:
實驗序號 | 實驗操作 | 實驗現象 |
I | 將其中一份渾濁液過濾,向濾液中放入Mg條
| i. 濾液澄清透明,用激光照射有丁達爾現象。 ii. 放入Mg條后,立即有無色氣泡產生,氣體可燃,濾液中出現白色渾濁。 iii. 一段時間后開始出現棕褐色渾濁物,Mg條表面也逐漸變為棕褐色,產生氣泡的速率變緩慢。 |
II | 向另一份渾濁液中放入大小相同的Mg條
| iv. 棕褐色渾濁物的量明顯多于實驗I,Mg條表面棕褐色更深,其他現象與ii、iii相同。 |
已知:AgOH不穩定,立即分解為Ag2O(棕褐色或棕黑色),Ag粉為黑色,AgCl、Ag2O可溶于濃氨水生成Ag(NH3)2+
(1)濾液所屬分散系為________。
(2)現象ii中無色氣泡產生的原因是_________(寫出化學方程式)。
(3)現象iii中,導致產生氣泡的速率下降的主要影響因素是________。
(4)甲認為Mg條表面的棕褐色物質中一定有Ag和Ag2O,其中生成Ag的離子方程式為____。
(5)甲設計實驗檢驗Ag:取實驗I中表面變為棕褐色的Mg條于試管中,向其中加入足量試劑a,反應結束后,繼續向其中加入濃硝酸,產生棕色氣體,溶液中有白色不溶物。
① 白色不溶物為_____(填化學式),棕色氣體產生的原因是_____(寫離子方程式)。
② 試劑a為________,加入試劑a的目的是________。
③ 該實驗能證明棕褐色物質中一定有Ag的實驗現象是________。
(6)甲進一步設計實驗驗證了Mg條表面的棕褐色物質中有Ag2O,實驗方案是:取實驗I中表面變為棕褐色的Mg條_________。
(7)綜合上述實驗,能說明存在AgCl(s) ![]() Ag+(aq) + Cl-(aq)的證據及理由有________。
Ag+(aq) + Cl-(aq)的證據及理由有________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】強酸與強堿的稀溶液發生中和反應的熱效應為H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、濃硫酸、稀硝酸分別與0.1 mol·L1的NaOH溶液恰好完全反應,放出的熱量與消耗NaOH溶液的體積之間的關系如圖所示(CH3COOH電離要吸熱)。則下列描述正確的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、濃硫酸、稀硝酸分別與0.1 mol·L1的NaOH溶液恰好完全反應,放出的熱量與消耗NaOH溶液的體積之間的關系如圖所示(CH3COOH電離要吸熱)。則下列描述正確的是
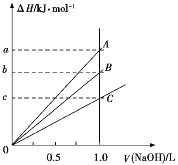
A.A表示稀硝酸與NaOH溶液的反應
B.B表示稀醋酸與NaOH溶液的反應
C.b=5.73
D.C表示濃硫酸與NaOH溶液的反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某柔性屏手機的柔性電池以碳納米管做電極材料,以吸收ZnSO4溶液的有機高聚物做固態電解質,其電池總反應為:
MnO2+![]() Zn +(1+
Zn +(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
其電池結構如圖1所示,圖2是有機高聚物的結構片段。


下列說法中,不正確的是
A. 碳納米管具有導電性,可用作電極材料
B. 放電時,電池的正極反應為:MnO2+e+H+==MnOOH
C. 充電時,Zn2+移向Zn膜
D. 合成有機高聚物的單體是:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應物和生成物均為氣態的平衡體系,平衡常數表達式為K=![]() ,有關該平衡體系的說法錯誤的是
,有關該平衡體系的說法錯誤的是
A. 升高溫度,該反應平衡常數K的變化無法判斷
B. 增大壓強,W的質量分數減小
C. 該反應的化學方程式為3Z(g)+2W(g)![]() X(g)+2Y(g)
X(g)+2Y(g)
D. 增大X氣體的濃度平衡向正反應方向移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.碳﹣12 原子和碳﹣13 原子的中子數相同
B.KMnO4 和 K2 MnO4 中有相同的原子團
C.Fe2+和 Fe3+都屬于鐵元素,核外電子數不同
D. 和
和 化學性質相似
化學性質相似
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4、H2、C都是優質的能源物質,它們燃燒的熱化學方程式為:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
(1)在深海中存在一種甲烷細菌,它們依靠酶使甲烷與O2作用產生的能量存活,甲烷細菌使1mol甲烷生成CO2氣體與液態水,放出的能量________(填“>”“<”或“=”)890.3kJ。
(2)甲烷與CO2可用于合成水煤氣(主要成分是一氧化碳和氫氣):CH4+CO2=2CO+2H2,1gCH4完全反應可釋放15.46kJ的熱量,則:
①能表示該反應過程中能量變化的是________(填字母)。
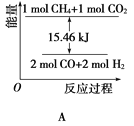



②若將物質的量均為1mol的CH4與CO2充入某恒容密閉容器中,體系放出的熱量隨著時間的變化如圖所示,則CH4的轉化率為________。
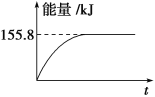
(3)C(s)與H2 (g)不反應,所以C(s)+2H2(g)=CH4(g)的反應熱無法直接測量,但通過上述反應可求出C(s)+2H2(g)=CH4(g)的反應熱ΔH=_____。
(4)目前對于上述三種物質的研究是燃料研究的重點,下列關于上述三種物質的研究方向中可行的是_______(填字母)。
A.尋找優質催化劑,使CO2與H2O反應生成CH4與O2,并放出熱量
B.尋找優質催化劑,在常溫常壓下使CO2分解生成碳與O2
C.尋找優質催化劑,利用太陽能使大氣中的CO2與海底開采的CH4合成水煤氣(CO、H2)
D.將固態碳合成為C60,以C60作為燃料
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2S與CO2在高溫下發生反應:H2S(g)+CO2(g) ![]() COS(g)+H2O(g)。在610 K時,將0.10 mol CO2與0.40 mol H2S充入2.5 L的空鋼瓶中,反應平衡后水的物質的量分數為0.02。
COS(g)+H2O(g)。在610 K時,將0.10 mol CO2與0.40 mol H2S充入2.5 L的空鋼瓶中,反應平衡后水的物質的量分數為0.02。
①向反應器中再分別充入下列氣體,能使H2S轉化率增大的是________(填標號)。
A. H2S B. CO2 C.COS D.N2
②在620 K重復實驗,平衡后水的物質的量分數為0.03,該反應的ΔH________0(填“>”“<”或“=”)。
③H2S的平衡轉化率α1=_____%,反應平衡常數K=______。(第③小題要寫計算過程)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用“銀-Ferrozine”法測室內甲醛含量的原理為:

已知:吸光度與溶液中有色物質的濃度成正比
下列說法正確的是
A. 反應①中參與反應的HCHO為30g時轉移電子2mol
B. 可用雙氧水檢驗反應②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2時反應②中參加反應的Ag一定為8mol
D. 理論上測得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com