
鎂錳干電池的電化學反應式為:Mg+2MnO2+H2O  Mg(OH)2+Mn2O3。下列說法不正確的是:
Mg(OH)2+Mn2O3。下列說法不正確的是:
| A.鎂為負極,發生氧化反應 |
| B.可以選擇堿性溶液作為電解質 |
| C.反應后正極和負極附近溶液的pH均升高 |
D.正極的電極反應為:2MnO2+H2O+2e- Mn2O3+2OH- Mn2O3+2OH- |
C
解析試題分析:鎂錳干電池的電化學反應式為Mg+2MnO2+H2O═Mg(OH)2+Mn2O3,分析可知鎂失電子發生氧化反應,做負極,故A正確;鎂錳干電池的電化學反應式為:Mg+2MnO2+H2O═Mg(OH)2+Mn2O3,負極電極反應為Mg-2e-+2OH-=Mg(OH)2,電解質溶液為堿性溶液,故B正確;負極鎂失電子生成的鎂離子和氫氧根結合生成氫氧化鎂沉淀,Mg-2e-+2OH-=Mg(OH)2,氫氧根離子濃度減小,正極電極反應2MnO2+H2O+2e-═Mn2O3+2OH-過程中生成氫氧根離子,所以正極附近溶液pH增大,負極附近溶液pH減小,故C錯誤;正極是MnO2得到電子發生還原反應生成Mn2O3,正極的電極反應為2MnO2+H2O+2e-═Mn2O3+2OH-,故D正確;故選C。
考點:考查原電池原理的分析應用。


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:單選題
LiFePO4新型鋰離子電池因其原材料豐富、對環境友好、循環性能和安全性能好的特點,具有廣闊的應用前景。已知該電池放電時的電極反應式為:
正極:FePO4+Li++e-=LiFePO4,負極:Li-e-=Li+,下列說法中正確的是
| A.充電時陽極反應為Li++e-=Li |
| B.充電時動力電池上標注“-”的電極應與外接電源的負極相連 |
| C.放電時電池內部Li+向負極移動 |
| D.放電時,在正極上是Li+得電子被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
2013年12月31日夜,上海外灘運用LED產品進行了精彩紛呈的跨年燈光秀。下圖是一種氫氧燃料電池驅動LED發光的裝置。下列有關敘述正確的是 
| A.a處通入氧氣 |
| B.b處為電池正極,發生了還原反應 |
| C.該裝置中只涉及兩種形式的能量轉化 |
| D.P-型半導體連接的是電池負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知蓄電池在放電時起原電池的作用,在充電時起電解池的作用。汽車上用的鉛蓄電池是以一組充滿海綿狀灰鉛的鉛板和另一組結構相似的充滿二氧化鉛的鉛板組成。兩個電極用稀硫酸作電解質溶液。在放電時,兩極發生的反應可分別表示為:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充電時,兩極發生的反應分別表示為:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
則在放電時,下列說法中正確的是( )
| A.充滿海綿狀灰鉛的鉛板為電源正極 |
| B.充滿二氧化鉛的鉛板為電源負極 |
| C.鉛板在放電時發生氧化反應 |
| D.鉛板在放電時發生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
燃料電池具有能量轉化率高、無污染等特點,下圖為Mg-NaClO燃料電池結構示意圖。下列說法正確的是( )
| A.鎂作Y電極 |
| B.電池工作時,Na+向負極移動 |
| C.廢液的pH大于NaClO溶液的pH |
| D.X電極上發生的反應為ClO-+2H2O-4e-=ClO3-+4H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有A、B、C、D四種金屬,當A、B組成原電池時,電子流動方向A B;當A、D組成原電池時,A為正極;B與C構成原電池時,電極反應式為C2++2e-=C,B-2e-=B2+,則A、B、C、D金屬性由強到弱的順序為( )。
B;當A、D組成原電池時,A為正極;B與C構成原電池時,電極反應式為C2++2e-=C,B-2e-=B2+,則A、B、C、D金屬性由強到弱的順序為( )。
A.A>B>C>D B.A>B>D>C
C.D>A>B>C D.D>C>A>B
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
早在1807年化學家戴維用電解熔融氫氧化鈉制得鈉:4NaOH(熔融)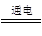 4Na+O2↑+2H2O;后來呂薩克用鐵與熔融氫氧化鈉作用也制得鈉,反應原理為3Fe+4NaOH
4Na+O2↑+2H2O;后來呂薩克用鐵與熔融氫氧化鈉作用也制得鈉,反應原理為3Fe+4NaOH 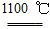 Fe3O4+2H2↑+4Na↑。下列有關說法正確的是 ( )
Fe3O4+2H2↑+4Na↑。下列有關說法正確的是 ( )
| A.電解熔融氫氧化鈉制鈉,陽極發生的電極反應為2OH--2e-=H2↑+O2↑ |
| B.若用戴維法與呂薩克法制得等量的鈉,則兩反應中轉移的電子總數也相同 |
| C.呂薩克法制鈉的原理是利用鐵的還原性比鈉強 |
| D.目前工業上常用電解熔融氯化鈉法制鈉(如下圖),電解槽中石墨為陽極,鐵為陰極 |
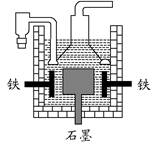
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關電化學知識的描述正確的是 ( )
| A.CaO+H2O=Ca(OH)2,可以放出大量的熱,故可把該反應設計成原電池,把其中的化學能轉化為電能 |
| B.某原電池反應為Cu+2AgNO3=Cu(NO3)2+2Ag,裝置中的鹽橋中可以是裝有含瓊膠的KCl飽和溶液 |
| C.因為鐵的活潑性強于銅,所以將鐵、銅用導線連接后放入濃硝酸中,若能組成原電池,必是鐵作負極,銅作正極 |
| D.理論上說,任何能自發進行的氧化還原反應都可設計成原電池 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
如圖所示,?為直流電源,?為浸透飽和氯化鈉溶液和酚酞試液的濾紙,?為電鍍槽。接通電路(未閉合K)后發現?上的c點顯紅色。為實現鐵片上鍍銅,接通K后,使c、d兩點短路。下列敘述不正確的是( )。
| A.b為直流電源的負極 |
| B.f極為陰極,發生還原反應 |
| C.e極材料為鐵片,f極材料為銅片 |
| D.可選用CuSO4溶液或CuCl2溶液作電鍍液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com