
【題目】下列根據實驗操作和現象所得出的結論不正確的是
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 向NaHS溶液中滴入酚酞 | 溶液變紅色 | HS-水解程度大于電離程度 |
B | 向濃度均為0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出現藍色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入濃鹽酸,將產生的氣體通入硅酸鈉溶液中 | 產生白色渾濁 | 酸性:鹽酸>碳酸>硅酸 |
D | 向盛有KI3溶液的兩試管中分別加入淀粉溶液和AgNO3溶液 | 前者溶液變藍色,后者有黃色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D
【答案】C
【解析】
A. NaHS溶液中存在平衡:HS-+H2O![]() H2S+OH-,HS-
H2S+OH-,HS-![]() H++S2-,向NaHS溶液中滴入酚酞,溶液變紅色,溶液呈堿性,說明HS-水解程度大于電離程度,實驗目的和結論一致,A項正確;
H++S2-,向NaHS溶液中滴入酚酞,溶液變紅色,溶液呈堿性,說明HS-水解程度大于電離程度,實驗目的和結論一致,A項正確;
B. 溶度積小的先生成沉淀,向濃度為0.1molL-1的MgCl2、CuCl2混合溶液中逐滴加入氨水先出現藍色沉淀,說明Ksp[Cu(OH)2]較小,B項正確;
C. 濃鹽酸具有揮發生,反應產生的二氧化碳中含有氯化氫氣體,干擾二氧化碳與硅酸鈉反應生成硅酸,無法證明碳酸酸性強于硅酸,C項錯誤;
D. 向盛有KI3溶液的兩試管中分別加入淀粉溶液和AgNO3溶液,前者溶液變藍色,說明溶液中含有碘,后者有黃色沉淀,說明溶液中含有碘離子,原來的溶液是KI3溶液,由現象可知,KI3溶液中存在I3-![]() I2+I-平衡,D項正確;
I2+I-平衡,D項正確;
答案選C。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】A—F是幾種典型有機代表物的分子模型,請看圖回答下列問題。
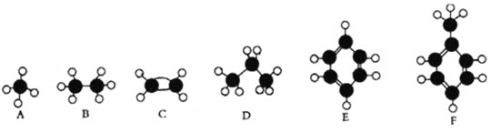
(1)常溫下含碳量最高的是________(填對應字母);
(2)一鹵代物種類最多的是 ___________(填對應字母);
(3)A、B、D三種物質的關系為____________________________________
(4)F中一定在同一個平面的原子數目為_____________________
(5)寫出C使溴水褪色的方程式 ___________
(6)寫出E發生溴代反應的化學方程式______________________________;
(7)寫出C的官能團的名稱______________________
(8)F的二溴取代產物有_____________種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為將含有的FeCl3、FeCl2、CuCl2的廢液中的Cu2+還原回收,某同學在含有ag鐵粉的容器中加入廢液,探究了加入廢液體積與完全反應后體系中固體質量的關系,部分實驗數據如下表所示。已知:廢液中c(Cu2+)=0.7 mol·Lˉ1;廢液體積大于0.5L,充分反應后才能檢測出Cu2+。

下列說法不正確的是
A. 當鐵粉與0.25L廢液反應完全后,固體成分為Fe與Cu
B. 當鐵粉與1L廢液反應完全后,再加入廢液時發生的離子反應為Fe +2Fe3+=3Fe2+
C. 廢液中c(Fe3+)=0.2 mol·Lˉ1
D. 要將1L廢液中的Cu2+全部還原,則至少需要鐵粉44.8g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙變紅色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在普通鋁中加入少量Cu和Mg后,形成一種稱為拉維斯相的MgCu2微小晶粒,其分散在Al中可使得鋁材的硬度增加、延展性減小,形成所謂“堅鋁”,是制造飛機的主要村料。回答下列問題:
(1)下列狀態的鎂中,電離最外層一個電子所需能量最大的是____________(填標號)。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一種有機化合物,分子中氮、碳的雜化類型分別是__________、__________。乙二胺能與Mg2+、Cu2+等金屬離子形成穩定環狀離子,其原因是__________,其中與乙二胺形成的化合物穩定性相對較高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔點如下表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔點/°C | 1570 | 2800 | 23.8 | 75.5 |
解釋表中氧化物之間熔點差異的原因__________。
(4)圖(a)是MgCu2的拉維斯結構,Mg以金剛石方式堆積,八面體空隙和半數的四面體空隙中,填入以四面體方式排列的Cu。圖(b)是沿立方格子對角面取得的截圖。可見,Cu原子之間最短距離x=__________pm,Mg原子之間最短距離y=__________pm。設阿伏加德羅常數的值為NA,則MgCu2的密度是__________g·cm3(列出計算表達式)。


查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁及其化合物在生產生活中有著廣泛的用途。
Ⅰ.高嶺土化學組成為:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量雜質和水分。聚合氯化鋁是一種新型、高效絮凝劑和凈水劑,其單體是液態的堿式氯化鋁[Al2(OH)nCl6-n]。用高嶺土制備堿式氯化鋁的工藝流程如下:

根據流程圖回答下列問題:
(1)實驗室配制4mol/L的鹽酸1000mL需要用到的玻璃儀器有燒杯、玻璃棒、量筒、____________________等。
(2)加適量鋁粉時所發生的離子反應方程式為________________________________。
Ⅱ.鋁和鎂的堿式碳酸鹽(AlxMgy(OH)z(CO3)w·nH2O)是一種中和胃酸過多的常用藥物,某化學興趣小組通過以下實驗探究該藥物主要成分的化學式:
甲同學取該堿式鹽9.03 g充分灼燒至恒重,測得剩余固體質量為5.13 g;
乙同學取相同質量的堿式鹽使其溶于足量的鹽酸中,收集到氣體體積為336mL(已換算為標準狀況);繼續向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。試通過計算確定該堿式碳酸鹽的化學式________。(寫出計算過程,只有答案不給分)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下能實現的是( )
①鹽鹵(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 無水MgCl2
無水MgCl2
②鋁土礦![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 無水FeCl2
無水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的粗表,①~⑧分別表示元素周期表中對應位置的元素
① | |||||||||||||||||
⑧ | ③ | ⑤ | |||||||||||||||
② | ④ | ||||||||||||||||
⑥ | |||||||||||||||||
⑦ | |||||||||||||||||
(1)用電子式表示①與②形成化合物A 的過程:________
(2)已知⑥原子的最外層有2個電子,請畫出⑥原子的結構示意圖:______________
(3)含有④元素的某種18 電子的離子與H+及OH-均可發生反應,請寫出該離子的電子式______
(4)元素③④⑤的簡單氣態氫化物的穩定性由強到弱的順序是_________(用化學式表示),其沸點由高到低的順序是_______ (用化學式表示)
(5)已知⑦的穩定化合態為+2 價,且⑦與③可按3:4 形成某化合物,該化合物具有較強氧化性, 可以與濃鹽酸反應并釋放出一種黃綠色的氣體, 請寫出該化學方程式:_________________
(6)①與③,①與④能形成18個電子的化合物,此兩種化合物在溶液中發生反應的化學方程式為_________。
(7)⑧的一種氧化物為無色氣體,在空氣中能迅速變成紅棕色。在一定條件下,2L的該無色氣體與0.5 L 的氧氣混合,該混合氣體被足量的NaOH溶液完全吸收后沒有氣體殘留,則所生成的一種含氧酸鹽的化學式是_________。
(8)兩種均含①與②③④四種元素的化合物相互反應放出氣體的離子方程式為_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將SO2通人BaCl2溶液至飽和的過程中,始終未觀察到溶液中出現渾濁,若再通入另種氣體A,則產生白色沉淀。制備氣體A的試劑不可能是( )
A.Cu和濃硝酸
B.NaOH和濃氨水
C.大理石和稀鹽酸
D.MnO2和濃鹽酸
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com