
【題目】含鈷化合物在機械制造、磁性材料等領域具有廣泛的應用,請回答下列問題:
(1)基態Co3+的價電子排布圖為____。
(2)鈷的配合物[Co(NH3)5Br](NO3)2
①第一電離能N_____O(填“大于”、“小于”或“不能確定”);兩種配位原子的雜化軌道類型均為____;
②鈷離子周圍配位鍵數目(配位數)是 ___;N03-的空間構型為____;
③已知Br的含氧酸酸性由強到弱的順序為HBrO4>HBrO3>HBrO2>HBrO,其原因是____。
(3)某鈷氧化物品體具有CoO2的層狀結構如下圖所示(小球表示Co,大球表示O)。下列用粗線面出的結構單元不能描述CoO2)的化學組成的是_____

(4)Co的另一種氧化物的晶胞如圖,已知鈷原子的半徑為apm,氧原子的半徑為b pm,它們在晶體中是緊密接觸的,鈷原子填在氧原子的 ___填“正八面體”、“正四面體”或“立方體”)空隙;鈷原子與跟它次近鄰的氧原子之間的距離為____;在該鈷的氧化物品體中原子的空間利用率為____(均用含a、b的計算表達式表示)。

【答案】 ![]() 大于 sp3 6 平面(正)三角形 含氧酸的中心元素 相同時,非羥基氧越多,中心元素的正電性越高,導致Br-O-H中的O的電子向Br偏移,在水分子作用下也就越易電離H+ D 正八面體
大于 sp3 6 平面(正)三角形 含氧酸的中心元素 相同時,非羥基氧越多,中心元素的正電性越高,導致Br-O-H中的O的電子向Br偏移,在水分子作用下也就越易電離H+ D 正八面體 ![]()
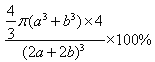
【解析】(1)鈷價電子為9,基態Co3+的價電子排布圖為![]() ;(2)①氮的3P處于半充滿狀態,第一電離能N大于O;兩種配位原子的雜化軌道類型均為sp3 ;②鈷離子周圍上下左右前后位置有氧原子,配位鍵數目(配位數)是6;氮形成3個δ鍵,sp2雜化,N03-的空間構型為平面(正)三角形 ;③已知Br的含氧酸酸性由強到弱的順序為HBrO4>HBrO3>HBrO2>HBrO,其原因是含氧酸的中心元素 相同時,非羥基氧越多,中心元素的正電性越高,導致Br-O-H中的O的電子向Br偏移,在水分子作用下也就越易電離H+;(3)CoO2的重復結構單元示意圖中Co、O原子數目之比應為1:2,由圖象可知:A中Co、O原子數目之比為1:4×1/2=1:2,符合,B中Co、O原子數目之比為(1+4×1/4):4=1:2,符合,C中Co、O原子數目之比為4×1/4:4×1/2=1:2,符合,D中Co、O原子數目之比為1:4×1/4=1:1,不符合,故選D。(4)鈷原子填在氧原子的正八面體的空隙里,鈷原子與跟它次近鄰的氧原子之間的距離為
;(2)①氮的3P處于半充滿狀態,第一電離能N大于O;兩種配位原子的雜化軌道類型均為sp3 ;②鈷離子周圍上下左右前后位置有氧原子,配位鍵數目(配位數)是6;氮形成3個δ鍵,sp2雜化,N03-的空間構型為平面(正)三角形 ;③已知Br的含氧酸酸性由強到弱的順序為HBrO4>HBrO3>HBrO2>HBrO,其原因是含氧酸的中心元素 相同時,非羥基氧越多,中心元素的正電性越高,導致Br-O-H中的O的電子向Br偏移,在水分子作用下也就越易電離H+;(3)CoO2的重復結構單元示意圖中Co、O原子數目之比應為1:2,由圖象可知:A中Co、O原子數目之比為1:4×1/2=1:2,符合,B中Co、O原子數目之比為(1+4×1/4):4=1:2,符合,C中Co、O原子數目之比為4×1/4:4×1/2=1:2,符合,D中Co、O原子數目之比為1:4×1/4=1:1,不符合,故選D。(4)鈷原子填在氧原子的正八面體的空隙里,鈷原子與跟它次近鄰的氧原子之間的距離為![]() pm;每個晶胞中含有的Co原子為:8×1/8+6×1/2=4,O為12×1/4+1=4,4個Co和O原子的體積為
pm;每個晶胞中含有的Co原子為:8×1/8+6×1/2=4,O為12×1/4+1=4,4個Co和O原子的體積為![]() ×4,晶胞的體積:(2a+2b)3,在該鈷的氧化物品體中原子的空間利用率為
×4,晶胞的體積:(2a+2b)3,在該鈷的氧化物品體中原子的空間利用率為![]() 。
。


 智慧小復習系列答案
智慧小復習系列答案科目:高中化學 來源: 題型:
【題目】在關于下圖所示的原電池中,正確的是
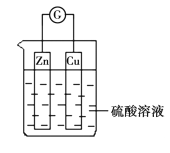
A. Zn被還原
B. 鋅片上的電子經導線流向銅片
C. 該原電池運行一段時間后銅片的質量將增加
D. 該原電池將電能轉變為化學能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溫州某學生用0.1000mol/L NaOH溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步: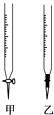
A.檢查滴定管是否漏水
B.用蒸餾水洗干凈滴定管
C.取下堿式滴定管用標準的NaOH溶液潤洗后,將標準液注入堿式滴定管“0”刻度以上2~3cm處,再把堿式滴定管固定好,調節液面至“0”刻度或“0”刻度以下
D.用待測定的溶液潤洗酸式滴定管
E.用酸式滴定管取稀鹽酸20.00mL,注入錐形瓶中,加入酚酞
F.把錐形瓶放在滴定管下面,瓶下墊一張白紙,邊滴邊搖動錐形瓶直至滴定終點,記下滴定管液面所在刻度
G.另取錐形瓶,再重復操作一次
完成以下填空:
(1)操作F中應該選擇圖中 滴定管(填標號)。
(2)滴定時邊滴邊搖動錐形瓶,眼睛應觀察 。
A.滴定管內液面的變化 B.錐形瓶內溶液顏色的變化
滴定終點溶液顏色的變化是 .若指示劑改為甲基橙則顏色的變化是 。
(3)滴定結果如表所示:
滴定次數 | 待測液體積/mL | 標準溶液的體積/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中誤差較大的是第 次實驗,造成這種誤差的可能原因是 。
A.堿式滴定管在裝液前未用標準NaOH溶液潤洗2~3次
B.滴定開始前堿式滴定管尖嘴部分有氣泡,在滴定終點讀數時未發現氣泡
C.滴定開始前堿式滴定管尖嘴部分沒有氣泡,在滴定終點讀數時發現尖嘴部分有氣泡
D.達到滴定終點時,仰視溶液凹液面最低點讀數
E.滴定過程中,錐形瓶搖蕩得太劇烈,以致有些液滴飛濺出來
(4)該鹽酸的濃度為mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將20mL 0.5molL﹣1K2SO3溶液逐滴加入到20mL 0.2molL﹣1 硫酸酸化的紫色KMnO4溶液中,溶液恰好變為無色.則Mn元素在產物中的存在形態是( )
A.Mn
B.Mn2+
C.Mn2O3
D.K2MnO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上常用濃氨水檢查氯氣管道是否泄漏,發生反應為:8NH3 +3C12=N2+6NH4C1, 該反應屬于
A. 置換反應 B. 分解反應 C. 化合反應 D. 復分解反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請完成下列問題
(1)已知紅磷比白磷穩定,則反應
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(紅磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的關系是△H1△H2(填“>”、“<”)
(2)由N2O和NO反應生成1mol N2和NO2的能量變化如圖所示,請寫出該反應的熱化學方程式
(3)在298K、101kPa時,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3 ,
則△H3與△H1和△H2之間的關系正確的是 .
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=﹣72kJmol﹣1 , 相關鍵能數據如表:
物質 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化學鍵斷裂時需要吸收的能量(kJ) | 436 | 200 | a |
則表中a= .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】恒溫下,物質的量之比為2∶1的SO2和O2的混合氣體在容積為2L的恒容密閉容器中發生反應:2SO2(g)+O2(g)![]() 2SO3(g)(正反應為放熱反應),n(SO2)隨時間變化關系如下表:
2SO3(g)(正反應為放熱反應),n(SO2)隨時間變化關系如下表:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列說法正確的是( )
A. 該反應進行到第3分鐘時,逆反應速率大于正反應速率
B. 若要提高SO2的轉化率,可用空氣代替純氧氣并鼓入過量空氣
C. 從反應開始到達到平衡,用SO3表示的平均反應速率為0.01mol/(L·min)
D. 容器內達到平衡狀態時的壓強與起始時的壓強之比為5∶4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如下圖所示裝置可以完成一系列實驗(圖中夾持裝置已略去)

請回答下列問題:
Ⅰ. 若氣體a是Cl2,裝置A、B、C中的試劑依次為: FeCl2溶液、淀粉KI溶液、石蕊溶液。
(1)A溶液由淺綠色變為棕黃色,反應的離子方程式為_________________________________。
(2)B瓶中的淀粉KI溶液變為藍色,反應的離子方程式為______________________________。
(3)C瓶中的現象為_______________________________________________________________。
(4)D裝置中試劑為_______________________________________________________________。
II.若氣體a是SO2,裝置A、B、C中的試劑依次為:品紅溶液、酸性高錳酸鉀溶液、氫硫酸(硫化氫的水溶液)。
(1)A瓶中品紅和B瓶中酸性高錳酸鉀溶液均褪色,其中體現了SO2漂白性的是 _____(填寫序號A或B)。
(2)C瓶中產生淡黃色沉淀, 反應的化學方程式_________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com