
【題目】控制適合的條件,將反應2Fe3++2I-![]() 2Fe2++I2設計成如圖所示的原電池。下列判斷不正確的是( )
2Fe2++I2設計成如圖所示的原電池。下列判斷不正確的是( )
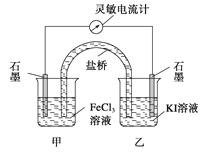
A.反應開始時,乙中石墨電極上發生氧化反應
B.反應開始時,甲中石墨電極上的Fe3+被還原
C.電流計讀數為零時,反應達到化學平衡狀態
D.電流計讀數為零后,在甲中溶入FeCl2固體,乙中的石墨電極為負極
科目:高中化學 來源: 題型:
【題目】一定條件后發生下列反應能夠導致固體物質增重的是( )
A. 鋁與Fe2O3發生鋁熱反應 B. 將鋅粒投入Cu(NO3)2溶液
C. 氫氣通過灼熱的CuO粉末 D. 二氧化碳通過Na2O2粉末
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學課外興趣小組探究銅與濃硫酸的反應情況.甲.乙.丙三位同學進行了下列實驗:取12.8g銅片和20ml.18mol/L的濃硫酸放在圓底燒瓶中共熱,直至反應完畢,最后發現燒瓶中還有銅片剩余外,同時根據所學的知識認為還有較多的硫酸剩余.
(1)請寫出銅跟濃硫酸反應的化學方程式: ,
試問:為什么較多的余酸不再與銅片繼續反應?簡述理由: .
可以證明有余酸的實驗方案是 (填寫字母,錯選或多選扣分).
a.再加入鐵粉 b.再滴入BaCl2溶液
c.再加入銀 d.再滴入Na2CO3溶液
(2)甲學生設計求余酸濃度的實驗方案是測定產生氣體的量.其方法有多種,請問下列方案中不可行的是 (填寫字母,錯選或多選扣分).
a.將產生的氣體緩緩通過預先稱量盛有堿石灰的干燥管,結束反應后再次稱量.
b.將產生的氣體緩緩通入酸性高錳酸鉀溶液,再加入足量BaCl2溶液,過濾、洗滌、干燥、稱量沉淀.
c.用排水法測定其產生氣體的體積(折算成標準狀況).
d.用排飽和NaHSO3溶液的方法測出其產生氣體的體積(折算成標準狀況).
(3)乙同學設計測定余酸濃度的實驗方案是:測定反應后的混合液中Cu2+的量.在反應后的溶液中加蒸餾水稀釋至100ml,加入足量Na2S溶液,充分反應后,過濾.洗滌.干燥、稱量沉淀.請寫出生成沉淀的離子方程式: .
(4)根據甲、乙兩同學的實驗方案,除測算產生氣體的物質的量或反應掉的銅的物質的量外,尚缺少的測量數據是 .
(5)丙同學提出甲、乙兩同學的實驗方案設計的復雜,為此他設計了下列較為簡易的實驗方案:取出反應后的銅片,進行洗滌.干燥.稱量.若稱得剩余銅片的質量為Wg,測得反應后溶液的體積為Vml,請計算剩余硫酸的物質的量濃度= mol/L(用含W.V的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如果實行海水淡化來供應居民飲用水,下列方法中在原理上完全不可行的是( )
A. 加明礬使海水中的鹽沉淀出來而淡化
B. 利用太陽能使海水升溫,通過蒸餾而使其淡化
C. 將海水緩慢降溫凝固以獲取淡水
D. 將海水通過離子交換樹脂以除去金屬陽離子及酸根陰離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2 L容積不變的容器中,發生N2+3H2 ![]() 2NH3的反應。現通入4 mol H2和4 mol N2,10 s內用H2表示的反應速率為0.12 mol/(L·s),則10 s后容器中N2的物質的量是
2NH3的反應。現通入4 mol H2和4 mol N2,10 s內用H2表示的反應速率為0.12 mol/(L·s),則10 s后容器中N2的物質的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)將鋅片和銀片浸入稀硫酸中組成原電池,兩電極間連接一個電流表。
鋅片上發生的電極反應:__________________;銀片上發生的電極反應:_________________。
(2)若該電池中兩電極的總質量為60 g,工作一段時間后,取出鋅片和銀片洗凈干燥后稱重,總質量為47 g,試計算:
①產生氫氣的體積(標準狀況)___________L;
②通過導線的電量________C。(已知NA=6.02×1023mol-1,電子電荷為1.60×10-19C)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于敞口容器中的化學反應:Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g),下列敘述中不正確的是( )

A. Zn和H2SO4的總能量大于ZnSO4和H2的總能量
B. 反應過程中能量關系可用上圖表示
C. 若將該反應設計成原電池,則Zn為負極
D. 若將該反應設計成原電池,當有32.5g鋅溶解時正極放出11.2 L氣體
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com