
【題目】下列不屬于等電子體的是( )
A.N2和 COB.CO2和N2O
C.PH3和NH3D.CO2和SiO2
 鴻圖圖書寒假作業假期作業吉林大學出版社系列答案
鴻圖圖書寒假作業假期作業吉林大學出版社系列答案科目:高中化學 來源: 題型:
【題目】相同質量的鋁分別投入足量的下列物質中反應生成氫氣,消耗溶質物質的量最少的是
A. 稀硫酸 B. 稀鹽酸 C. 氫氧化鋇溶液 D. 氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組開展下列實驗探究活動:

(1)裝置A中反應的化學方程式為_____。
(2)設計實驗:利用裝置A中產生的氣體證明+4價硫具有氧化性:_____。
(3)選用下面的裝置和藥品探究亞硫酸與次氯酸的酸性強弱:

裝置連接順序為A、C、__、__、D、F,其中裝置C的作用是_____,通過___________________現象即可證明亞硫酸的酸性強于次氯酸。
(4)利用G裝置可測定裝置A殘液中SO2的含量。量取 1mL殘液于燒瓶中,加適量的水稀釋,加熱使SO2全部逸出并與錐形瓶中H2O2完全反應(SO2+H2O2=H2SO4),然后用0.1000mol/LNaOH標準溶液進行滴定,至終點時消耗NaOH溶20.00mL。

①G中球形冷凝管的冷凝水進口為_____(填“a”或“b”)。
②殘液中SO2含量為____g/L。
③經多次測定發現,測定值始終高于實際值,則其原因是_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的項重大貢獻。
(1)某課外實驗小組欲探究鋁和銅的金屬性(原子失電子能力)強弱,同學們提出了如下實驗方案:
A.比較鋁和銅的硬度和熔點
B.比較二者在稀硫酸中的表現
C.用鋁片、銅片、硫酸鋁溶液、硫酸銅溶液,比較二者的活動性
D.分別做鋁片、銅片與NaOH溶液反應的實驗
E.將鋁片、銅片用導線連接后共同投入稀鹽酸中接入電流計,觀察電流方向
上述方案中能達到實驗目的的是_________________。
(2)現有如下兩個反應:A.NaOH+HCl=NaCl+H2O B.Zn+H2SO4=ZnSO4+H2↑。上述反應中能設計成原電池的是________ (填字母代號),作負極的物質發生了________反應(填“氧化”或“還原”)。
(3)將純鋅片和純銅片按如圖所示方式插入100mL相同濃度的稀硫酸一段時間,回答下列問題:

①下列說法正確的是________ (填字母代號)。
A.甲、乙均為化學能轉變為電能的裝置 B.乙中銅片上沒有明顯變化
C.甲中銅片質量減少、乙中鋅片質量減少 D.兩燒杯中溶液的酸性均減弱
②在相同時間內,兩燒杯中產生氣泡的速度:甲________乙(填“>”、“<”或“=”)。原因是________。
③當甲中產生1.12L(標準狀況)氣體時,將鋅、銅片取出,再將燒杯中的溶液稀釋至1L,測得溶液中c(H+)=0.1mol/L(設反應前后溶液體積不變)。試確定原稀硫酸的物質的量濃度為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NO、NO2是汽車尾氣中主要的含氮氧化物。回答下列問題:
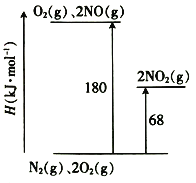
(1)已知氮氧化物轉化過程中的能量變化如圖(圖中表示生成2 mol NO2的能量變化)。1 mol NO氧化為NO2的焓變△H=___________。
(2)某溫度下,反應的平衡常數如下:
a.2NO2(g) ![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) ![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反應趨勢較大的反應是__________(填“a”或“b”);反應2NO(g)+O2(g) ![]() 2NO2(g)的K=_____________。
2NO2(g)的K=_____________。
(3)已知反應2NO(g)+O2(g) ![]() 2NO2的正反應速率v正=k1Cm(NO)cn(O2),其中k為速率常數,可通過下列實驗數據計算k、m、n。
2NO2的正反應速率v正=k1Cm(NO)cn(O2),其中k為速率常數,可通過下列實驗數據計算k、m、n。
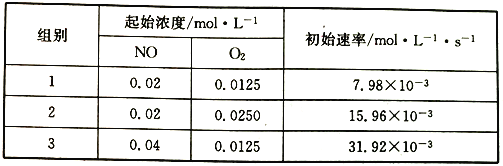
則k1=______________,m=______________,n=______________,
(4)已知該反應的歷程為:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2慢反應
2NO2慢反應
其中可近似認為第二步反應不影響第一步的平衡,第一步反應中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列敘述正確的是________(填字母)。
A.第一步反應的平衡常數K=![]()
B.v(第一步的正反應)<v(第二步的反應)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2與O2的碰撞100%有效
(5)一定條件下測得容器中NO、O2、NO2濃度發生如下變化。
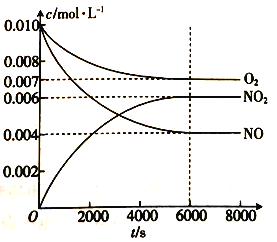
①NO的平衡轉化率為 _______________。
②該溫度下反應2NO(g)+O2(g)![]() 2NO2(g)的平衡常數為______________(保留整數)
2NO2(g)的平衡常數為______________(保留整數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于反應A(g)+B(g) ![]() 3C(g)(正反應為放熱反應),下述為平衡狀態標志的是( )
3C(g)(正反應為放熱反應),下述為平衡狀態標志的是( )
①單位時間內A、B生成C的分子數與C分解的分子數相等 ②外界條件不變時,A、B、C濃度不隨時間變化 ③體系溫度不再變化 ④體系的壓強不再變化 ⑤體系的分子總數不再變化
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】空氣中的CO、NO、NO2、SO2都能使人中毒,其中易與人體中的血紅蛋白結合,使血紅蛋白失去運載O2能力的是( )
A. CO B. NO C. NO2 D. SO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】學習中經常應用類推法。下列表格左邊正確,類推法應用于右邊也正確的是( )
A | 向FeCl2溶液中滴入氯水 2Fe2++Cl2=2Fe3++2Cl— | 向FeCl2溶液中滴入碘水 2Fe2++I2=2Fe3++2I— |
B | 向澄清石灰水中通入少量CO2氣體 Ca2++2OH—+CO2 =CaCO3↓+H2O | 向澄清石灰水中通入少量SO2 氣體 Ca2++2OH—+SO2=CaSO3↓+H2O |
C | 向Na2CO3溶液中滴入稀HNO3
| 向Na2SO3溶液中滴入稀HNO3
|
D | 鋅粒放入硫酸亞鐵溶液中 Zn+Fe2+=Zn2++Fe | 鈉投入硫酸銅溶液中 2Na+Cu2+=2Na++Cu |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)現有A、B、X、Y、Z五種短周期元素,原子序數依次增大。它們的性質或原子結構如下表:
元素 | 性質或原子結構 |
A | 原子核內只有一個質子 |
B | 單質是空氣中含量最多的氣體 |
X | 原子的最外層電子數是次外層電子數的3倍 |
Y | 短周期元素中原子半徑最大的元素 |
Z | 最高正化合價與最低負化合價的代數和為6 |
請回答:
①X元素在元素周期表中的位置是______________;
②Z單質通入Y的最高價氧化物對應水化物的溶液中,可以得到漂白液,相應反應的離子方程式為___________________________________________________;
③化合物甲由A和B兩種元素組成且質量比為3:14,甲與X單質在催化劑、加熱條件下發生的反應是工業上制取硝酸的基礎,寫出該反應的化學方程式____________。
(2)短周期元素X、Y、Z在周期表中的位置關系如圖所示
X | ||
Y | ||
Z |
①X元素單質的化學式是_________,若X核內中子數與質子數相等,則X單質的摩爾質量為________;
②Y單質的電子式是_________;Z與鈣形成的化合物的電子式是__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com