
納米鈷(Co)常用于CO加氫反應的催化劑,500 K時有催化反應:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有關說法正確的是( )
CH4(g)+H2O(g) ΔH<0。下列有關說法正確的是( )
| A.納米技術的應用,提高了催化劑的催化性能 |
| B.縮小容器體積,平衡向正反應方向移動,CO的濃度減小 |
| C.溫度越低,越有利于CO催化加氫 |
| D.從平衡體系中分離出H2O(g)能加快正反應速率 |
 開心蛙狀元測試卷系列答案
開心蛙狀元測試卷系列答案科目:高中化學 來源: 題型:單選題
可逆反應aA(g) + bB(g)  cC(g) + dD(g),反應過程中,當其它條件不變時,C的百分含量(C%)與溫度(T)和壓強(P)的關系如圖下列敘述正確的是
cC(g) + dD(g),反應過程中,當其它條件不變時,C的百分含量(C%)與溫度(T)和壓強(P)的關系如圖下列敘述正確的是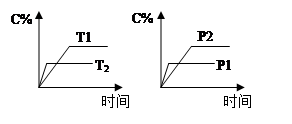
| A.達平衡后,若升溫,平衡左移 |
| B.達平衡后,加入催化劑則C%增大 |
| C.化學方程式中a+b>c+d |
| D.達平衡后,減少A的量有利于平衡向右移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
N2 (g)+3H2 (g)  2NH3(g) ΔH=-92.4 kJ·mol-1。 1L密閉恒容容器中,反應體系中各物質濃度隨時間變化的曲線如圖示。
2NH3(g) ΔH=-92.4 kJ·mol-1。 1L密閉恒容容器中,反應體系中各物質濃度隨時間變化的曲線如圖示。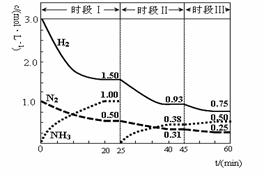
下列說法錯誤的是:
| A.前20分鐘反應物的轉化率為50% |
| B.第25分鐘改變的條件是將NH3從反應體系中分離出去 |
| C.時段Ⅰ僅將初始投放的物質濃度增至原來的2倍,則反應物的轉化率增大,平衡常數增大 |
| D.若第60分鐘時反應又達到了平衡,則時段Ⅲ改變的條件是降低溫度 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法或解釋不正確的是
A.等物質的量濃度的下列溶液中,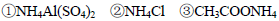
 由大到小的順序是
由大到小的順序是
B.室溫下,向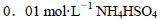 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: 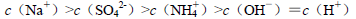

在任何溫度下都能自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
化學平衡常數(K)、弱酸的電離平衡常數(Ka)、難溶物的溶度積常數(Ksp)是判斷物質性質或變化的重要的平衡常數。下列關于這些常數的說法中,正確的是( )
| A.平衡常數的大小與溫度、濃度、壓強、催化劑等有關 |
| B.當溫度升高時,弱酸的電離平衡常數Ka變小 |
| C.Ksp(AgCl)>Ksp(AgI) ,由此可以判斷AgCl(s) + I-(aq)=AgI(s)+ Cl-(aq)能夠發生 |
| D.Ka(HCN)<Ka(CH3COOH) ,說明物質的量濃度相同時,氫氰酸的酸性比醋酸強 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在m A(g)+n B(g) p C(g)+q D(g)的反應中,經5 min達到平衡,測得A增加3 mol·L-1,B增加1 mol·L-1,C減少2 mol·L-1,此時若給體系加壓,平衡不移動,則m∶n∶p∶q為( )
p C(g)+q D(g)的反應中,經5 min達到平衡,測得A增加3 mol·L-1,B增加1 mol·L-1,C減少2 mol·L-1,此時若給體系加壓,平衡不移動,則m∶n∶p∶q為( )
| A.2∶3∶2∶3 | B.2∶2∶3∶3 |
| C.3∶1∶2∶2 | D.3∶1∶2∶3 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知反應4NH3+5O2 4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列正確的關系是 ( )。
4NO+6H2O,若反應速率分別用v(NH3)、v(O2)、v(NO)、v(H2O)表示,則下列正確的關系是 ( )。
A.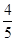 v(NH3)=v(O2) v(NH3)=v(O2) |
B.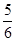 v(O2)=v(H2O) v(O2)=v(H2O) |
C.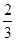 v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.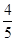 v(O2)=v(NO) v(O2)=v(NO) |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在常溫下,X2(g)和H2反應生成HX的平衡常數如表中所示,僅依據K的變化,關于等物質的量濃度的H2與X2的反應,下列說法正確的是( )
| 化學方程式 | 平衡常數K |
F2+H2 2HF 2HF | 6.5×1095 |
Cl2+H2 2HCl 2HCl | 2.6×1033 |
Br2+H2 2HBr 2HBr | 1.9×1019 |
I2+H2 2HI 2HI | 8.7×102 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定溫度下,在2 L密閉容器中加入納米級Cu2O并通入0.1 mol H2O(g),發生反應:2H2O(g)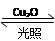 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同時間產生O2的物質的量見下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同時間產生O2的物質的量見下表:
| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com