
【題目】元素R,X,T,Z,Q在元素周期表中的相對位置如下表所示,其中R單質在暗處與H2劇烈化合并發生爆炸.則下列判斷正確的是( ) 
A.非金屬性:Z<T<X
B.R與Q的電子數相差26
C.氣態氫化物穩定性:R<T<Q
D.最高價氧化物的水化物的酸性:R>Q
【答案】B
【解析】解:R單質在暗處與H2劇烈化合并發生爆炸,R為F元素,由元素在周期表中的位置可知,T為Cl元素,Q為Br元素,X為S元素,Z為Ar元素,
A.Z為Ar元素,最外層為穩定結構,金屬性與非金屬性在同周期中最弱,同周期自左而右金屬性減弱,故非金屬性Z<X<T,故A錯誤;
B.R為F元素,Q為Br元素,原子序數相差26,故B正確;
C.同主族自上而下,非金屬性減弱,故非金屬性F>Cl>Br,非金屬性越強,氣態氫化物越穩定,故穩定性HF>HCl>HBr,故C錯誤;
D.R不存在最高價氧化物的水化物,故D錯誤;
故選B.
R單質在暗處與H2劇烈化合并發生爆炸,R為F元素,由元素在周期表中的位置可知,T為Cl元素,Q為Br元素,X為S元素,Z為Ar元素,結合元素周期律解答.


科目:高中化學 來源: 題型:
【題目】下列關于物質分類的說法正確的是
A. 墨水、豆漿都屬于膠體B. 漂白粉、石英都屬于純凈物
C. 氯化銨、次氯酸都屬于強電解質D. 油脂、蛋白質都屬于高分子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生產環氧乙烷(![]() )的反應為: 2CH2=CH2(g) + O2(g)
)的反應為: 2CH2=CH2(g) + O2(g) ![]() 2
2 ![]() (g) △H=-106 kJ/mol
(g) △H=-106 kJ/mol
其反應機理如下:
①Ag + O2→AgO2 慢 ②CH2=CH2 + AgO2→![]() +AgO 快
+AgO 快
③CH2=CH2 + 6AgO→2CO2+2H2O+6Ag 快
下列有關該反應的說法正確的是( )
A. 反應的活化能等于 106 kJ/mol B. AgO2也是該反應的催化劑
C. 增大乙烯的濃度能顯著提高環氧乙烷的生成速率 D. 該反應的原子利用率為100%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸亞鐵晶體是一種淡黃色粉末,常用于照相顯影劑及制藥工業,也是電池材料的制備原料。某化學興趣小組對草酸亞鐵晶體的一些性質進行探究。
(1)甲組同學用如圖所示裝置測定草酸亞鐵晶體(FeC2O4·xH2O)中結晶水含量,將石英玻璃管(帶兩端開關K1和K2)(設為裝置A)稱重,記為ag。將樣品裝入石英玻璃管中,再次將裝置稱重,記為b g。按圖連接好裝置進行實驗。
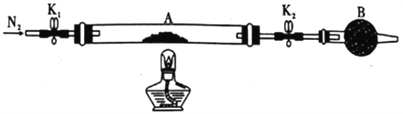
a.打開K1和K2,緩緩通入N2; b.點燃酒精燈加熱; c.熄滅酒精燈;d.冷卻至室溫;e.關閉K1和K2; f.稱重A;g.重復上述操作,直至A恒重,記為cg。
①儀器B的名稱是__________ ,通入N2的目的是___________。
②根據實驗記錄,計算草酸亞鐵晶體化學式中的x =____________(列式表示);若實驗時a、b次序對調,會使x值______________ (填“偏大” “無影響”或“偏小”)。
(2)乙組同學為探究草酸亞鐵的分解產物,將(1)中已恒重的裝置A接入圖14所示的裝置中,打開K1和K2,緩緩通入N2,加熱。實驗后裝置A中殘留固體為黑色粉末。

①裝置C、G中的澄清石灰水均變渾濁,說明分解產物中有____________(填化學式)。
②裝置F中盛放的物質是___________(填化學式)。
③將裝置A中的殘留固體溶于稀鹽酸,無氣泡,滴入KSCN溶液無血紅色,說明分解產物中A的化學式為________。
④寫出草酸亞鐵(FeC2O4)分解的化學方程式:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質的化學式、名稱(或俗名)和分類三者不相符的是()
A. CaO、生石灰、氧化物 B. CH4、沼氣、有機物
C. Na2CO3、純堿、堿 D. CH3COOH、醋酸、有機物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】等質量的碳酸鈣與過量的鹽酸在不同的實驗條件下進行反應,測得在不同時間(t)內產生氣體體積(V)的數據如下圖所示,根據圖示分析實驗條件,下列說法中一定不正確的是( )
組別 | 對應曲線 | c(HCl) / mol·L-1 | 反應溫度 / ℃ | 鐵的狀態 | |
1 | a | 30 | 粉末狀 | ||
2 | b | 30 | 粉末狀 | ||
3 | c | 2.5 | 塊狀 | ||
4 | d | 2.5 | 30 | 塊狀 |
A. 第4組實驗的反應速率最慢
B. 第1組實驗中鹽酸的濃度可能最大
C. 第2組實驗中鹽酸濃度可能等于2.5mol/L
D. 第3組實驗的反應溫度低于30 ℃
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知X(g) + 4Y(g) ![]() 2Z(g) ΔH = -a kJ·mol-1(a > 0)。一定條件下將1 mol X 和4 mol Y通入2 L的恒容密閉容器中,反應10 min時,測得Y的物質的量為3.2 mol。下列說法正確的是( )
2Z(g) ΔH = -a kJ·mol-1(a > 0)。一定條件下將1 mol X 和4 mol Y通入2 L的恒容密閉容器中,反應10 min時,測得Y的物質的量為3.2 mol。下列說法正確的是( )
A. 在10 min內,X和Y反應放出的熱量為0.4a kJ
B. 在10 min時,Y和Z的物質的量之比為2 : 1
C. 升髙反應溫度,逆反應速率增大,正反應速率減小
D. 達到平衡狀態時,X、Y的濃度不再改變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com