
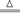 2Fe2O3+8SO2
2Fe2O3+8SO2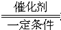 2SO3
2SO3 H2SO4
H2SO4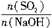 =x,試寫出x在不同取值范圍時,n(NaHSO3)的值或n(NaHSO3)與n(SO2)、n(NaOH)間的關系式。
=x,試寫出x在不同取值范圍時,n(NaHSO3)的值或n(NaHSO3)與n(SO2)、n(NaOH)間的關系式。| x=n(SO2)/n(NaOH) | n(NaHSO3) |
| | |
| | |
| | |
 Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2  aHSO3。根據題給條件,對上述反應運用極值假設法進行分析討論。第(3)步考查計算題中范圍討論的基礎知識,以及過量問題和平行反應的計算。
aHSO3。根據題給條件,對上述反應運用極值假設法進行分析討論。第(3)步考查計算題中范圍討論的基礎知識,以及過量問題和平行反應的計算。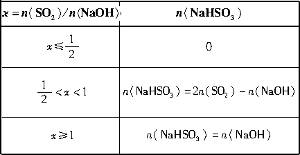
 Na2SO3+H2O
Na2SO3+H2O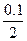 mol=12.6g
mol=12.6g NaHSO3
NaHSO3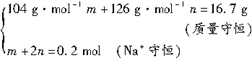
 nNa2SO3+mNaHSO3+nH2O
nNa2SO3+mNaHSO3+nH2O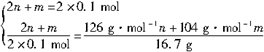
 Na2SO3+H2O(Ⅰ)
Na2SO3+H2O(Ⅰ) NaHSO3(Ⅱ)
NaHSO3(Ⅱ)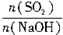 ≤
≤ 時,反應按(Ⅰ)式進行,SO2全部反應,生成物皆為Na2SO3,故n(NaHSO3)=0。
時,反應按(Ⅰ)式進行,SO2全部反應,生成物皆為Na2SO3,故n(NaHSO3)=0。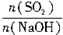 ≥1時,反應按(Ⅱ)式進行,NaOH全部反應,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。
≥1時,反應按(Ⅱ)式進行,NaOH全部反應,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。 <x<1時,(Ⅰ)(Ⅱ)兩個反應平行進行,NaOH與SO2兩物質均耗盡,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕
<x<1時,(Ⅰ)(Ⅱ)兩個反應平行進行,NaOH與SO2兩物質均耗盡,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕

科目:高中化學 來源:不詳 題型:判斷題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.紅色先加深后褪至無色 | B.紅色立刻褪去,溶液變為無色 |
| C.紅色加深,顏色不褪 | D.紅色既不加深也不褪去 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
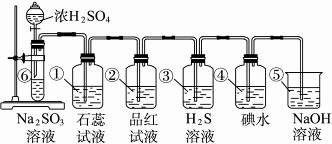
查看答案和解析>>
科目:高中化學 來源:不詳 題型:實驗題
 )溶液顏色褪去的是 ;
)溶液顏色褪去的是 ;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com