
【題目】A、D、E、W是中學常見的四種元素,原子序數依次增大。A的原子最外層電子數是次外層的2倍,D的氧化物屬于兩性氧化物,D、E位于同周期,A、D、E的原子最外層電子數之和為14,W是人體必需的微量元素,缺乏W會導致貧血癥狀。
(1)A在元素周期表中的位置是。
(2)下列事實能用元素周期律解釋的是(填字母序號)。
a . D的最高價氧化物對應水化物的堿性弱于Mg(OH)2
b. E的氣態氫化物的穩定性小于HF
c. WE3的溶液可用于刻蝕銅制的印刷電路板
(3)E的單質可以從NaBr溶液中置換出Br2單質,從原子結構的角度解釋其原因是。
(4)①工業上用電解法制備D的單質,反應的化學方程式為。
②家用“管道通”的有效成分是燒堿和D的單質,使用時需加入一定量的水,此時發生反應的化學方程式為。
(5)W的單質可用于處理酸性廢水中的NO3- , 使其轉換為NH4+ , 同時生成有磁性的W的氧化物X,再進行后續處理。
① 上述反應的離子方程式為。
② D的單質與X在高溫下反應的化學方程式為。
【答案】
(1)第二周期,第IVA族
(2)ab
(3)Cl(可用E代替)和Br同主族,最外層均為7個電子,電子層數、原子半徑Br大,核對最外層電子的引力Br小于Cl,原子得電子能力Br小于Cl,元素的非金屬性Br弱于Cl,單質的氧化性Br2弱于Cl2
(4)2Al2O3(熔融) ![]() 4A1+3O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
4A1+3O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(5)3Fe+NO3-+2H++H2O=Fe3O4+NH4+,8Al+3Fe3O4 ![]() 4Al2O3+9Fe
4Al2O3+9Fe
【解析】解:(1)C元素在元素周期表中位于第二周期,第ⅣA族。
所以答案是:第二周期,第ⅣA族;
(2)a . 同一周期,從左到右,元素的金屬性逐漸減弱,鋁的金屬性比鎂弱,因此氫氧化鋁的堿性弱于Mg(OH)2,與元素周期律有關,正確;b. 同一主族,從上到下,元素的非金屬性逐漸減弱,氯元素的非金屬小于氟,則氯化氫的穩定性小于HF,與元素周期律有關,正確;c. 氯化鐵溶液可用于刻蝕銅制的印刷電路板,是因為鐵離子的氧化性比銅離子強,與元素周期律無關,錯誤;
所以答案是:ab;
(3) Cl和Br同主族,最外層均為7個電子,電子層數、原子半徑Br大,核對最外層電子的引力Br小于Cl,原子得電子能力Br小于Cl,元素的非金屬性Br弱于Cl,單質的氧化性Br2弱于Cl2,因此氯氣可以從NaBr溶液中置換出Br2單質。
所以答案是:Cl和Br同主族,最外層均為7個電子,電子層數、原子半徑Br大,核對最外層電子的引力Br小于Cl,原子得電子能力Br小于Cl,元素的非金屬性Br弱于Cl,單質的氧化性Br2弱于Cl2;
(4)①工業上用電解熔融的氧化鋁的方法冶煉鋁,反應的化學方程式為2Al2O3(熔融) ![]() 4A1+3O2↑。
4A1+3O2↑。
所以答案是:2Al2O3(熔融) ![]() 4A1+3O2↑;
4A1+3O2↑;
②鋁與氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,反應的化學方程式為2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
所以答案是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(5)鐵可用于處理酸性廢水中的NO3-,使其轉換為NH4+,同時生成有磁性的四氧化三鐵。
①反應的離子方程式為3Fe+NO3-+2H++H2O=Fe3O4+NH4+。
所以答案是:3Fe+NO3-+2H++H2O=Fe3O4+NH4+;
②鋁與四氧化三鐵在高溫下發生鋁熱反應,反應的化學方程式為8Al+3Fe3O4 ![]() 4Al2O3+9Fe。
4Al2O3+9Fe。
所以答案是:8Al+3Fe3O4 ![]() 4Al2O3+9Fe。
4Al2O3+9Fe。


 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:
【題目】美國科學家將兩種元素鉛和的原子核對撞,獲得一種質子數為118,質量數為293的超重元素,該元素原子核內的中子數和核外電子數之差為
A.57B.118C.175D.293
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵紅(主要成分為Fe2O3)是一種用途廣泛的顏料,用廢鐵屑制備鐵紅的流程如下:

(1)操作Ⅰ的名稱是_________。
(2)檢驗FeCO3沉淀是否洗凈的實驗方法是________。
(3)加入NH4HCO3溶液的反應除了生成FeCO3沉淀,還會生成一種氣體,生成氣體的離子方程式為________。
(4)在空氣中煅燒FeCO3的化學方程式是________,若煅燒不充分,產品Fe2O3中會有FeO,為了避免產品中有FeO,可以采取的措施是________。
(5)稱取3.0 g 產品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反應完全。若此產品中只含有FeO、Fe2O3,求算產品中Fe2O3的質量分數,寫出計算過程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列儀器可用于加熱且不必墊石棉網的是 ( )
①試管 ②燒杯 ③坩堝 ④蒸發皿 ⑤錐形瓶 ⑥蒸餾燒瓶
A. ②④⑤ B. ①③④ C. ①②③ D. ②⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨反應為N2+3H22NH3 , 今有A、B、C、D四個容器,每個容器中有兩種操作,兩種操作分別達到平衡后,操作1中N2和操作2中NH3轉化率之和一定不為1的是(起始體積相等)( )
A.恒溫恒容:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3
B.恒溫恒壓:操作1:加1 mol N2+3 molH2 , 操作2:加2 mol NH3
C.恒溫恒容:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH3
D.恒溫恒壓:操作1:加1 mol N2+3 molH2 , 操作2:加3 mol NH3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀鹽酸,生成氣體的量隨鹽酸加入量的變化關系如右圖所示。則下列離子組在對應的溶液中一定能大量共存的是

A.a點對應的溶液中:Na+、AlO2-、SO42-、NO3-
B.b點對應的溶液中:Ba2+、K+、NO3-、Cl-
C.c點對應的溶液中:Na+、Ag+、Mg2+、NO3-
D.d點對應的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溶液M中含有MgCl2、KCl和AlCl3,某小組用下圖所示過程對其進行處理以獲得較純凈的AlCl3溶液。已知:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,請回答:
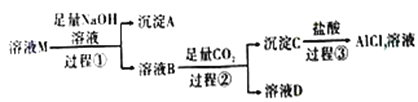
(1)沉淀A的化學式為_______,過程①中Al3+發生反應的離子方程式為_______。
(2)上述過程中的氫氧化鈉溶液_____(填“能”或“不能”)用氨水代替,原因是_______。
(3)溶液B中大量存在的陽離子是______,過程③反應的離子方程式為_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com