
將4 mol A氣體和2mol B氣體在2 L的密閉容器中混合,并在一定條件下發生如下反應:2A(g)+B(g) 2C(g),反應2 s后測得C的物質的量為1.2mol。下列說法正確的是( )
2C(g),反應2 s后測得C的物質的量為1.2mol。下列說法正確的是( )
| A.用物質B表示2s內的平均反應速率為0.6 mol/(L·s) |
| B.用物質A表示2 s內的平均反應速率為0.3 mol/(L·s) |
| C.2 s后物質A的轉化率為70% |
| D.2 s后物質B的濃度為0.35 mol/L |
B
解析試題分析: 2A(g)+B(g) 2C(g)
2C(g)
起始濃度(mol/L) 2 1 0
轉化濃度(mol/L) 0.6 0.3 0.6
2s后濃度(mol/L) 1.4 0.7 0.6
則用物質B表示2s內的平均反應速率為0.3mol/L÷2s=0.15 mol/(L·s),A不正確;
用物質A表示2s內的平均反應速率為0.6mol/L÷2s=0.3mol/(L·s),B正確;
2s后物質A的轉化率為 ,C不正確;
,C不正確;
2s后物質B的濃度為0.7mol/L,D不正確,答案選B。
考點:考查可逆反應的有關計算
點評:在進行可逆反應的有關計算時,一般采用“三段式”進行,即分別列出起始量、轉化量和平衡量或某時刻的量,然后依據已知條件列式計算即可,有利于培養學生的規范答題能力。


 教學練新同步練習系列答案
教學練新同步練習系列答案 課前課后同步練習系列答案
課前課后同步練習系列答案 課堂小作業系列答案
課堂小作業系列答案科目:高中化學 來源: 題型:單選題
關于下列四個說法正確的是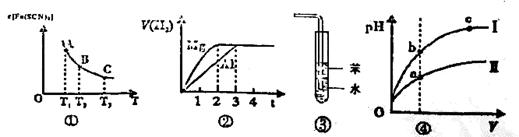
| A.已知圖①是體系Fe3++3SCN-=Fe(SCN)3中c[Fe(SCN)3]與溫度T的平衡圖像,則A點與B點相比,A點的Fe3+濃度大 |
| B.圖②表示鎂和鋁分別與等濃度、等體積的過量稀硫酸反應,產生氣體的體積V(H2) 與時間t的關系。則反應中鎂和鋁的反應速率之比為2 : 3 |
| C.圖③可用于吸收HCl氣體,并防倒吸 |
| D.圖④是某溫度下,相同體積,相同pH的鹽酸和醋酸溶液分別加水稀釋,pH隨溶液體積V變化的曲線。II為醋酸稀釋時pH的變化曲線 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將H2(g)和Br2(g)充入恒容密閉容器中,恒溫下發生反應H2(g)+Br2(g)  2HBr(g) (正反應放熱),平衡時Br2(g)的轉化率為a;若初始條件相同,絕熱下進行上述反應,平衡時Br2(g)的轉化率為b。 a與b的關系是
2HBr(g) (正反應放熱),平衡時Br2(g)的轉化率為a;若初始條件相同,絕熱下進行上述反應,平衡時Br2(g)的轉化率為b。 a與b的關系是
| A.a>b | B.a =b | C.a <b | D.無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一個體積固定的密閉容器中,進行可逆反應A(s)+3B(g)  3C (g) 。下列敘述中表明該可逆反應一定達到平衡狀態的是
3C (g) 。下列敘述中表明該可逆反應一定達到平衡狀態的是
①C的生成速率與C的分解速率相等;②單位時間內生成amol A,同時生成3amol B;
③B的濃度不再變化; ④混合氣體總的物質的量不再發生變化;
⑤A、B、C的物質的量之比為1:3:3; ⑥混合氣體的密度不再變化;
A.①③⑥ B.①③④⑥ C.①②③ D.①③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
COCl2(g)  CO(g)+Cl2(g);ΔH>0。當反應達到平衡時,下列措施:①升溫 ②恒容通入惰性氣體 ③增加CO濃度 ④減壓 ⑤加催化劑 ⑥恒壓通入惰性氣體,能提高COCl2轉化率的是( )
CO(g)+Cl2(g);ΔH>0。當反應達到平衡時,下列措施:①升溫 ②恒容通入惰性氣體 ③增加CO濃度 ④減壓 ⑤加催化劑 ⑥恒壓通入惰性氣體,能提高COCl2轉化率的是( )
| A.①②④ | B.①④⑥ |
| C.②③⑤ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
為探究足量鋅與稀硫酸的反應速率(以v(H2)表示),向反應混合液中加入某些物質,下列判斷正確的是( )
| A.加入NH4HSO4固體,v(H2)不變,生成H2量不變 |
| B.加入少量水,v(H2)減小,生成H2量減少 |
| C.加入CH3COONa固體,v(H2)減小,生成H2量不變 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量減少 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
X、Y、Z三種氣體,取X和Y按1︰1的物質的量之比混合,放入密閉容器中發生如下反應:X+2Y 2Z ,達到平衡后,測得混合氣體中反應物的總物質的量與生成物的總物質的量之比為3︰2,則Y的轉化率最接近于( )
2Z ,達到平衡后,測得混合氣體中反應物的總物質的量與生成物的總物質的量之比為3︰2,則Y的轉化率最接近于( )
| A.33% | B.40% | C.50% | D.66% |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
100mL 6 mol / L H2SO4跟過量鋅粉反應,在一定溫度下,為了減緩反應進行的速率,但又不影響生成氫氣的總量,可向反應物中加入適量的
| A.硫酸鉀溶液 | B.醋酸 | C.氯化鈉(固體) | D.鹽酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com