
【題目】二氯化二硫(S2Cl2)在工業上用于橡膠的硫化。為在實驗室合成S2Cl2,某化學研究性學習小組查閱了有關資料,得到如下信息:
①將干燥純凈的氯氣在110℃~140℃與硫反應,即可得S2Cl2粗品。
②有關物質的部分性質如下表:
物質 | 熔點/℃ | 沸點/℃ | 化學性質 |
S | 112.8 | 444.6 | 略 |
S2Cl2 | -77 | 137 | 與過量氯氣發生S2Cl2+Cl2 |
設計實驗裝置圖如下:

(1)儀器A的名稱是______________。
B中反應的離子方程式為_________________________________。
(2) S2Cl2遇水會生成黃色單質、一種能使品紅溶液褪色的氣體化合物及酸霧,D中的試劑應是________,寫出該反應的化學方程式__________________ 。
(3)裝置H的作用是_______________ ,其中發生反應的化學方程式為 ______________________。
(4)S2Cl2粗品中可能混有的雜質是SCl2、Cl2、S,為了提高S2Cl2的純度,關鍵的操作是控制好溫度和_______。
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 濃硫酸 2 S2Cl2+2H2O=4HCl+SO2↑+3S↓ 吸收尾氣,防止污染環境 Cl2+2NaOH=NaCl+NaClO+H2O 滴加濃鹽酸的速度不要過快
Mn2++Cl2↑+2H2O 濃硫酸 2 S2Cl2+2H2O=4HCl+SO2↑+3S↓ 吸收尾氣,防止污染環境 Cl2+2NaOH=NaCl+NaClO+H2O 滴加濃鹽酸的速度不要過快
【解析】
(1)由裝置圖可知B中反應,用固液加熱的方法制Cl2,常用濃鹽酸和二氧化錳反應制取;(2)氯氣制取過程中的除雜問題,先用飽和食鹽水除去氯氣中的HCl,再用濃硫酸進行干燥即可得純凈干燥的氯氣;S2Cl2能與水反應;(3)氯氣是有毒氣體,會污染空氣;(4) 由信息可知可能因溫度、水蒸氣、氯氣的量等因素會造成產品中引入雜質;據此分析解答。
(1)由儀器的形狀可知A為分液漏斗,用固液加熱的方法制Cl2,常用濃鹽酸和二氧化錳反應制取,反應的離子方程式為MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,故答案為:分液漏斗;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案為:分液漏斗;MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2) 氯氣制取過程中的產生雜質HCl、H2O,因此先用飽和食鹽水除去氯氣中的HCl,再用濃硫酸進行干燥即可得純凈干燥的氯氣,所以C中為飽和食鹽水,D中為濃硫酸;S2Cl2遇水會生成黃色單質硫、一種能使品紅溶液褪色的氣體化合物為二氧化硫及酸霧(HCl),反應的化學方程式為:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,故答案為:濃硫酸;2S2Cl2+2H2O=3S↓+SO2↑+4HCl;
(3) 反應過程中涉及有毒有害氣體,產生的尾氣會污染空氣,因此裝置H中的氫氧化鈉溶液可以吸收未反應的氣體(如氯氣等),防止污染環境,反應的化學方程式為Cl2+2NaOH=NaCl+NaClO+H2O,故答案為:吸收尾氣,防止污染環境;Cl2+2NaOH=NaCl+NaClO+H2O;
(4) 由信息可知,可能因溫度、水蒸氣因素引入SCl2、Cl2、S等雜質,為了提高S2Cl2的純度,關鍵的操作是控制好溫度,避免S2Cl2分解為硫和氯氣;若滴加鹽酸過快,造成反應過程中氯氣過量,導致副反應S2Cl2+Cl2![]() 2SCl2的發生,因此還應控制濃鹽酸的滴速不要過快,故答案為:控制濃鹽酸的滴速不要過快。
2SCl2的發生,因此還應控制濃鹽酸的滴速不要過快,故答案為:控制濃鹽酸的滴速不要過快。


科目:高中化學 來源: 題型:
【題目】有機物A的結構簡式為:![]()
(1)A的分子式為_____.
(2)A在NaOH水溶液中加熱,經酸化得到有機物B和D,D是芳香族化合物.當有1mol A發生反應時,最多消耗_____mol NaOH.
(3)B在一定條件下發生酯化反應可生成某五元環酯,該五元環酯的結構簡式為_____.
(4)寫出苯環上只有一個取代基且屬于酯類的D的所有同分異構體._____.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:常溫下甲胺(CH3NH2)的電離常數kb,pkb=-lgkb=3.4。CH3NH2+H2O![]() CH3NH3++OH-。下列說法不正確的是( )
CH3NH3++OH-。下列說法不正確的是( )
A. (CH3NH3)2SO4溶液中離子濃度:c(CH3NH3+)>c(SO42-)>c(H+)>c(OH-)
B. 常溫下,pH=3的鹽酸溶液和pH=11的CH3NH2溶液等體積混合,混合溶液呈酸性
C. 用標準濃度的鹽酸滴定未知濃度的CH3NH2溶液的實驗中,選擇甲基橙作指示劑
D. 常溫下向CH3NH2溶液滴加稀硫酸至c(CH3NH2)=c(CH3NH3+)時,溶液pH=10.6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:pNi=-lgc(Ni2+);常溫下,K(NiCO3)=1.4×10-7,H2S的電離平衡常數:Ka1=1.3×10-7,Ka2=7.1×10-15。常溫下,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加過程中pNi與Na2S溶液體積的關系如圖所示。下列說法不正確的是( )。
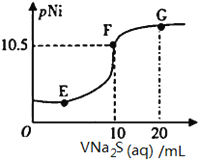
A. E、F、G三點中,F點對應溶液中水電離程度最小
B. 常溫下,Ksp(NiS)=1×10-21
C. 在NiS和NiCO3的濁液中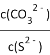 =1.4×1014
=1.4×1014
D. Na2S溶液中,S2-第一步水解常數Kh1=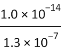
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】LED(Light EmittingDiode)即發光二極管,是一種能夠將電能轉化為光能的固態半導體器件。如圖是某課外活動小組設計的用化學電源使LED燈發光的裝置。下列說法不正確的是( )

A. 溶液中SO42-向銅片附近移動
B. 銅片上發生的反應為2H++2e-=H2↑
C. 導線中電子由鋅片流向銅片
D. 如果將鋅片換成鐵片,則電路中的電流方向不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是氧氣氧化某濃度Fe2+為Fe3+過程的實驗結果,下列有關說法正確的是
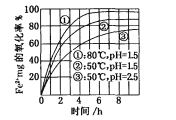
A. pH=1.5時氧化率一定比pH=2.5時大
B. 其他條件相同時,80℃的氧化率比50℃大
C. Fe2+的氧化率僅與溶液的pH和溫度有關
D. 該氧化過程的離子方程式為:Fe2++O2+4H+=Fe3++2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)濕法制各高鐵酸鉀(K2FeO4)的反應體系中有六種粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①寫出并配平濕法制高鐵酸鉀反應的離子方程式:______________________________
②每生成l mol FeO42-轉移__________mol電子,若反應過程中轉移了0.3 mol電子,則還原產物的物質的量為____mol。
③低溫下,在高鐵酸鈉溶液中加入KOH至飽和可析出高鐵酸鉀(K2FeO4)原因是__。
(2)工業上從海水中提取單質溴可采用如下方法:
①向海水中通入Cl2將海水中溴化物氧化,其離子方程式為____。
②向上述混合液中吹入熱空氣,將生成的溴吹出,用純堿溶液吸收,其化學方程式為__。
③將②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴轉化為單質溴,再用有機溶劑提取溴后,還可得到副產品Na2SO4。這一過程可用化學方程式表示為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某工廠在山坡坑道的倉庫里貯有氯氣鋼瓶。某天,有一只貯有氯氣的鋼瓶損壞,造成氯氣泄漏。
(1)處理鋼瓶的方法正確的是________。
A.鋼瓶推到坡下的小河里
B.把鋼瓶丟到深坑里,用石灰填埋
C.把鋼瓶扔到農田中
(2)鋼瓶處理后,工人應立即________。
A.轉移到坡下 B.轉移到坡上
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:2SO2 (g)+ O2(g) ![]() 2SO3(g) ΔH,有關數據如下:
2SO3(g) ΔH,有關數據如下:
T(℃) | 527 | 627 | 727 | 827 | 927 |
平衡常數K | 910 | 42 | 3.2 | 0.39 | 0.12 |
下列說法不正確的是
A. 根據平衡常數隨溫度的變化關系,判斷出ΔH<0
B. 保持其他條件不變,SO2的平衡轉化率α(727℃)<α(927℃)
C. 增大壓強、降低溫度能提高SO2的轉化率
D. SO3的穩定性隨溫度的升高而降低
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com