
【題目】硒元素(Se)是第4周期ⅥA族元素,單質有紅硒、黑硒和灰硒,灰硒是良好的半導體材料,硒最特殊的性質是在光照射下導電性可提高近千倍,可用于制造光電管。請回答下列問題:
(1)基態(tài)Se原子價電子的軌道表示式為__。
(2)As和Se是同一周期元素,As的第一電離能比Se大,原因是___。
(3)硒在空氣中燃燒能生成SeO2,常溫下,SeO2是易揮發(fā)的白色固體,熔點為340~350℃,315℃時升華,則SeO2固體是___晶體;寫出一種與SeO2互為等電子體的陰離子的化學式__。
(4)H2SeO4和H2SO4相似,是一種不易揮發(fā)的強酸。SeO42-的空間構型為___,中心原子的雜化方式為___。
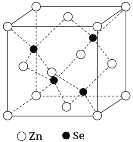
(5)硒化鋅是一種重要的半導體材料,其晶胞結構如圖所示,Zn原子的配位數(shù)為___,若該晶胞密度為ρg·cm-3,硒化鋅的摩爾質量為Mg·mol-1,用NA代表阿伏加德羅常數(shù),則晶胞參數(shù)a(即晶胞的邊長)為___nm。
【答案】![]() As的4p能級是半充滿狀態(tài),比較穩(wěn)定 分子 NO2- 正四面體形 sp3雜化 4
As的4p能級是半充滿狀態(tài),比較穩(wěn)定 分子 NO2- 正四面體形 sp3雜化 4 ![]() ×107
×107
【解析】
(1)硒為34號元素,有6個價電子, 所以基態(tài)Se原子價電子的軌道表示式為![]() 因此,本題正確答案是:
因此,本題正確答案是: ![]() ;
;
(2)同一周期中,元素的第一電離能隨著原子序數(shù)增大而呈增大趨勢,但第ⅤA族元素的P軌道上是半充滿狀態(tài),比較穩(wěn)定,所以第一電離能大于相鄰元素, As為第ⅤA族元素,Se為第IVA族元素,所以As的第一電離能比Se大,答案:As的4p能級是半充滿狀態(tài),比較穩(wěn)定;
(3) SeO2常溫下白色晶體,熔、沸點低,所以屬于分子晶體;二氧化硒分子中價層電子對=2+1/2(6-2×2)=3,Se原子的雜化類型為SP2,且含有一個孤電子對, 屬于V形;與NO2-的價電子和原子數(shù)都相等,屬于SeO2的等電子體,所以NO2-與SeO2互為等電子體;因此,本題答案是:分子晶體; NO2-;
(4) SeO42-的中心原子的價層電子對數(shù)為(6+2)/2=4,所以Se雜化方式為sp3雜化,離子中沒有孤電子對,所以SeO42-的立體構型是正四面體形。
因此,本題答案是: sp3;正四面體形。
(5)根據(jù)硒化鋅晶胞結構圖可以知道,每個鋅原子周圍有4個硒原子,每個硒原子周圍也有4個鋅原子,所以硒原子的配位數(shù)為4,該晶胞中含有硒原子數(shù)為8×1/8+6×1/2=4,含有鋅原子數(shù)為4,根據(jù)ρ=m/V=4M/NAV,所以V=4M/ρNA,則晶胞的邊長為![]() cm=
cm=![]() ×1010pm,
×1010pm,
因此,本題正確答案是:4; ![]() ×1010pm
×1010pm


科目:高中化學 來源: 題型:
【題目】科學研究發(fā)現(xiàn),具有高度對稱的有機分子具有致密性高,穩(wěn)定性強,張力能大等特點,因此這些分子成為化學界關注的熱點。立體烷烴中有一系列對稱結構的烴,如:![]() (正四面體烷C4H4)、
(正四面體烷C4H4)、![]() (棱晶烷C6H6)、
(棱晶烷C6H6)、![]() 立方烷C8H8)等,下列有關說法正確的是
立方烷C8H8)等,下列有關說法正確的是
A. 立體烷烴的C原子都形成4個單鍵,因此它們都屬于烷烴
B. 上述一系列物質互為同系物,它們的通式為C2nH2n(n≥2)
C. 棱晶烷與立方烷中碳原子均為飽和碳原子,其二氯代物的種數(shù)不同
D. 苯、盆烯(![]() )與棱晶烷屬于同分異構體
)與棱晶烷屬于同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種消毒殺菌效率高、二次污染小的水處理劑。實驗室可通過以下反應制得ClO2:KClO3+H2C2O4+H2SO4![]() ClO2↑+K2SO4+CO2↑+H2O(未配平)下列說法正確的是
ClO2↑+K2SO4+CO2↑+H2O(未配平)下列說法正確的是
A.KClO3在反應中得到電子B.ClO2是氧化產物
C.H2C2O4在反應中被還原D.1 mol KClO3參加反應有2 mol電子轉移
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一個密閉容器,中間有一可自由滑動的隔板(厚度可忽略)將容器分成兩部分。當左邊充入2molN2,右邊充入CO和CO2的混合氣體共18g時,隔板處于如圖位置(左、右兩側溫度相同)。右側CO2與CO分子數(shù)之比為( )
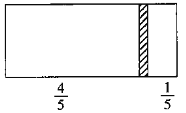
A.3:1B.1:1C.1:2D.1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合肥市某高中化學非限定性課程學習小組利用鐵銹(Fe2O3)做了系列實驗,物質之間的關系圖如下。
根據(jù)所學知識回答以下問題:
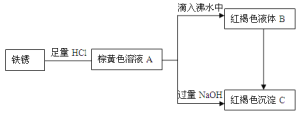
IHCl的配制
實驗室用密度為1.18g/mL,質量分數(shù)為36.5%濃鹽酸配制480mL0.1mol/L的鹽酸溶液。
(1)配制480mL0.1mol/L的鹽酸溶液需要濃鹽酸的體積為___mL。(保留2位有效數(shù)字)
(2)除了燒杯、玻璃棒、量筒、膠頭滴管和試劑瓶還需要的儀器有___。
(3)若出現(xiàn)如下情況,對所配溶液濃度將有何影響?(填“偏低”或“偏高”)
未洗滌燒杯___;定容時俯視刻線____。
II探究實驗
(1)寫出由A滴入到沸水中制備B的化學方程式。___
(2)下列說法正確的有___(填序號)。
①B轉換成C發(fā)生了化學反應
②由A制備B,加熱越久越好
③物質B具有丁達爾效應
④把B和C組成的混合物過濾,濾液是無色的
⑤整個過程都不涉及到氧化還原反應
(3)向紅褐色沉淀C中加入NaClO和NaOH混合溶液,生成一種高效殺菌凈水劑Na2FeO4,已知每生成0.2mol的Na2FeO4消耗0.3molNaClO,則該反應的還原產物為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】香豆素是一種天然香料,存在于黑香豆、蘭花等植物中。工業(yè)上常用水楊醛與乙酸酐在催化劑存在下加熱反應制得,反應如下(部分生成物已略去):

以下是由甲苯為原料生產香豆素的一種合成路線(部分反應條件及副產物已略去):
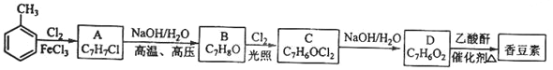
已知:① A中有五種不同化學環(huán)境的氫原子;②同一個碳原子上連有兩個羥基的結構不穩(wěn)定,易脫水形成羰基。請回答下列問題:
(1)香豆素的分子式為_______________。
(2)由甲苯生成A的反應類型為____________。A的化學名稱為___________。
(3)由B生成C的化學反應方程式為____________________。
(4)B的同分異構體中含有苯環(huán)的還有______種,其中在核磁共振氫譜中只出現(xiàn)四組峰的有______種。
(5)D的同分異構體中含有苯環(huán)的還有________種,其中屬于羧酸類的是_________(寫結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是實驗室制取氯氣并以氯氣為原料進行特定反應的裝置。其中:A中盛有MnO2,B中盛有濃鹽酸。

(1)用下列兩種方法制取氯氣:
①用含HCl146g的濃鹽酸與足量的MnO2反應;
②用87gMnO2與足量的濃鹽酸反應。不考慮HCl的揮發(fā),
則兩種方法生成的氯氣的量是方法①___②(填“>”、“<”或“=”)。
(2)儀器B的名稱是__。
(3)C中盛飽和食鹽水(氯氣在其中的溶解度很小),是為了除去氯氣中混有的__氣體。
(4)儀器D用來干燥氯氣,其中盛放的試劑是__。
(5)E中裝鐵粉,其中發(fā)生反應的化學方程式是__。
(6)G中盛有NaOH溶液,目的是___。其中發(fā)生反應的離子方程式是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以甲醛和苯酚為主要原料,經(jīng)下列轉化可合成酚醛樹脂和重要的有機合成中間體D(部分反應條件和產物已略去)
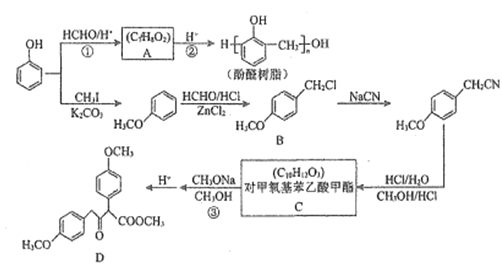
已知:R1CH2COOCH2+R2COOCH3![]() CH3OH+
CH3OH+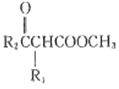
請回答下列問題:
(1)反應①的反應類型為___________;A的化學名稱為___________。
(2)C中所含官能團的名稱為___________;D的分子式為___________。
(3)反應②的化學方程式為______________________。
(4)A的下列性質中,能反映支鏈對苯環(huán)結構產生影響的是___________(填字母)。
a.能與氫氧化鈉溶液反應
b.能使酸性高錳酸鉀溶液褪色
c.向稀溶液中加入濃溴水后,產生沉淀
(5)芳香化合物E(C8H10O2)與B的水解產物互為同分異構體,1molE可與2 mol NaOH反應,其核磁共振氫譜中有3組峰且峰面積之比為3:1:1,則E有___________種可能的結構(不考慮立體異構)。
(6)以CH3OH和CH3ONa為原料(其他試劑任選),設計制備CH3COCH2 COOCH3的合成路線:CH3OH![]() ______。
______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某有機物結構如圖,下列說法中正確的是
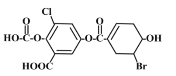
A. 該物質的化學式為C15H12O8BrCl
B. 該物質能與FeCl3溶液發(fā)生顯色反應
C. 1mol該物質最多能與3mol溴水發(fā)生加成反應
D. 一定條件下,1mol該物質最多能與7molNaOH反應
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com