
將ag Mg、Al合金完全溶解在V1L、c1mol/L的鹽酸溶液中,產生bgH2。再向反應后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀達到最大值,且沉淀質量為dg。則下列關系式錯誤的是( )
| A.合金中的物質的量為(24b-a)/9mol |
| B.d=a+17b |
C.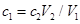 |
D.與金屬反應后剩余鹽酸的物質的量濃度為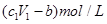 |
A、D
解析試題分析:A、設n(Mg)=xmol, n(Al)=ymol,
則有:24x+27y=a;x+1.5y=b/2
解之得: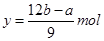
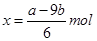
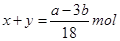
B、生成的沉淀的質量為氫氧化鎂跟氫氧化鋁的質量的和:也等于鎂和鋁的質量再加上氫氧根離子的質量,而氫氧根離子的質量在這里等于氫氧根離子的物質的量那氫氧根離子的摩爾質量之積,氫氧根離子的物質的量等于在這個反應過程中鎂跟鋁反應時所失去的電子的物質的量,又等于反應過程中酸中的氫所得到的電子的物質的量,也就是說氫氧根離子的物質的量等于氫氣的物質的量的二倍。所以有如下關系:d=a+17b
C、在這個過程中后邊加的氫氧化鈉可以理解為是剛好跟前面加的鹽酸進行中和反應。因此它們二者的物質的量相等,有: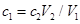
D、與金屬反應后剩余鹽酸的物質的量濃度為: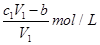
考點:鎂、鋁的性質。


 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案 浙大優學小學年級銜接導與練浙江大學出版社系列答案
浙大優學小學年級銜接導與練浙江大學出版社系列答案 小學暑假作業東南大學出版社系列答案
小學暑假作業東南大學出版社系列答案 津橋教育暑假拔高銜接廣東人民出版社系列答案
津橋教育暑假拔高銜接廣東人民出版社系列答案 波波熊暑假作業江西人民出版社系列答案
波波熊暑假作業江西人民出版社系列答案科目:高中化學 來源: 題型:單選題
用一小粒鈉投入水中,實驗操作和過程中不可能感知或觀察到的現象是
| A.鈉的熔點低 | B.鈉呈銀白色、硬度小 |
| C.鈉有延展性,導電性好 | D.鈉具有強還原性 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將ag鎂鋁合金投入到x mL 2mol/L的鹽酸中,金屬完全溶解后,再加入y mL 1mol/L的氫氧化鈉溶液,得到的沉淀量最大,質量為(a+1.7)g。下列說法不正確的是
| A.鎂鋁合金與鹽酸反應轉移電子總數為0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
有a、b、c、d、e五種金屬。已知:a、c均能與稀硫酸反應放出氣體;b能與d的硝酸鹽反應,置換出d單質;c與強堿溶液反應放出氣體;c、e在冷濃硫酸中發生鈍化。由此可判斷a、b、c、d、e依次是( )
| A.Al、Cu、Ag、Mg、Fe | B.Fe、Cu、Al、Ag、Mg |
| C.Mg、Cu、Al、Ag、Fe | D.Mg、Ag、Al、Cu、Fe |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(16分)鋼鐵企業酸洗鋼材時產生的廢液主要成分為Fe2+、H+、Cl-,可用下述方法處理該廢液,回收鹽酸和制備氧化鐵涂料。 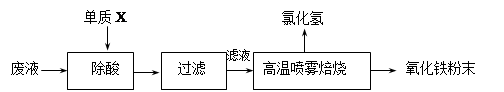
(1)單質X的化學式是 。
(2)氯化亞鐵溶液經高溫噴霧焙燒轉化為HCl氣體和氧化鐵粉末,有關的化學方程式依次為: 。
(3)某鐵紅涂料中除含有Fe2O3外,還可能添加有CuO或FeO中的一種,請設計實驗方案,探究該鐵紅涂料中添加物的成分。
① 提出合理假設
假設1:添加了CuO
假設2:添加了FeO
② 請設計方案,驗證上述假設,寫出實驗步驟、預期現象和結論。
限選試劑:鐵粉、3mol?L-1H2SO4、0.1 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步驟 | 預期現象和結論 |
| 步驟1.取少量樣品于試管中, ____________________________________________ | 樣品全部溶解,得到澄清的溶液。 |
| 步驟2. 步驟3. | ___________________________ ___________________________ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分) 某興趣小組進行“活潑金屬與酸反應”的實驗,將5.4g的鋁片投入500 mL 0.5 mol·L-1的硫酸溶液中,右圖為反應產生氫氣速率與反應時間的關系圖。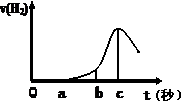
(1)關于圖像的描述不正確的是 (填序號,下同);
① o→a段不產生產生H2是室溫過低,反應難以發生。
② b → c段產生H2較快可能是反應放熱,溫度升高,加快了反應
③ c以后,產生H2速率逐漸下降原因可能是鋁片趨于消耗完全
(2)在b到c這段時間內,收集到氫氣VL(標準狀況),則這段時間內用硫酸表示的平均速率為 mol/(L·s)(假設反應前后溶液體積不變)。
(3)其他條件不變,現換用500 mL 1 mol·L-1鹽酸,產生氫氣速率普遍較使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快鋁與硫酸溶液制H2的反應速率,小組成員提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③將鋁片換成鋁粉 ④增加硫酸的濃度至18 mol/L ⑤加CH3COONa固體; ⑥加入少量Na2SO4溶液
(5)催化劑會影響反應速率,請根據①反應寫出FeCl3催化H2O2分解的另一反應原理(用離子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
為研究鐵質材料與熱濃硫酸的反應,某學習小組用碳素鋼(即鐵和碳的合金)進行了以下探究活動:
[探究一](1)將已去除表面氧化物的鐵釘(碳素鋼)放入冷濃硫酸中,10分鐘后移入硫酸銅溶液中,片刻后取出觀察,鐵釘表面無明顯變化,其原因是 。
(2)稱取碳素鋼6.0 g放入15.0 mL濃硫酸中,加熱,充分反應后得到溶液X并收集到混合氣體Y。
①甲同學認為X中除Fe3+之外還可能含有Fe2+。若要確認其中的Fe2+,應選用 (選填序號)。
A.KSCN溶液和氯水 B.鐵粉和KSCN溶液
C.濃氨水 D.酸性KMnO4溶液
②乙同學取560 mL(標準狀況)氣體Y通入足量溴水中,發生SO2+Br2+2H2O=2HBr+H2SO4反應,然后加入足量BaCl2溶液,經適當操作后得干燥固體4.66 g。由此推知氣體Y中SO2的體積分數為 。
[探究二]根據上述實驗中SO2體積分數的分析,丙同學認為氣體Y中還可能含有Q1和Q2兩種氣體,其中Q1氣體,在標準狀況下,密度為0.0893 g·L-1。為此設計了下列探究實驗裝置(假設有關氣體完全反應)。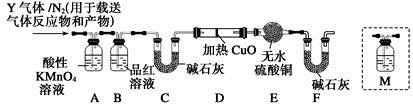
(3)裝置B中試劑的作用是 。
(4)分析Y氣體中的Q2氣體是如何生成的 (用化學方程式表示)。
(5)已知洗氣瓶M中盛裝澄清石灰水,為確認Q2的存在,需在裝置中添加洗氣瓶M于 (填序號)。
A.A之前 B.A—B間
C.B—C間 D.C—D間
(6)如果氣體Y中含有Q1,預計實驗現象應是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com