
【題目】I.計算以下數值(均為25℃時)
(1)某濃度的NH3·H2O溶液中,由水電離的c(H+)=1×10-12mol/L,該溶液的 pH=_________
(2)將pH=3的H2SO4 溶液和pH=12的NaOH溶液混合, 混合后所得溶液的PH=10,則H2SO4 溶液與NaOH溶液的體積比為______________
(3)向0.02mol/L的MgCl2溶液中加入NaOH固體,若要生成Mg(OH)2沉淀,溶液的pH最低為__________(已知Ksp[Mg(OH)2]=3.2×10-11,lg2.5=0.4)
II.(1)鹽堿地因含較多的![]() ,使得土壤呈堿性,不利于作物生長,通過施加適量石膏粉末(主要含有CaSO4,微溶于水)來降低土壤的堿性。寫出該過程中發生反應的化學方程式_______________________________
,使得土壤呈堿性,不利于作物生長,通過施加適量石膏粉末(主要含有CaSO4,微溶于水)來降低土壤的堿性。寫出該過程中發生反應的化學方程式_______________________________
(2)![]() 是一種無色或淡黃色液體,遇水劇烈反應得到二氧化硫和氯化氫,是一種常用的脫水劑。將
是一種無色或淡黃色液體,遇水劇烈反應得到二氧化硫和氯化氫,是一種常用的脫水劑。將![]() 與
與![]() 混合并加熱,可得到無水
混合并加熱,可得到無水![]() ,得到無水
,得到無水![]() 的化學方程式為______________________________
的化學方程式為______________________________
【答案】129:19.6Na2CO3+CaSO4═Na2SO4+CaCO3FeCl36H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑
【解析】試題分析:I.(1)氨水抑制了水的電離,氨水中氫離子是水電離的,據此計算出pH;
(2)先判斷酸堿過量問題,再利用pH=-lg(H+)計算;
(3)根據溶度積常數計算;
II.(1)根據水解原理和外界條件對鹽類水解的影響分析;
(2)SOCl2與水反應生成的氯化氫會對氯化鐵水解起到抑制作用。
解析:(1)某濃度的NH3H2O溶液中的氫離子是水電離的,也是溶液中氫離子濃度,即溶液中(H+)=1×10-12mol/L,則溶液的pH=12;
(2)pH=-lg(H+),pH=12的氫氧化鈉溶液中(H+)=1×10-12mol/L,c(OH-)=0.01mol/L。pH=3的H2SO4 溶液中氫離子濃度,則c(OH-)=(0.01mol/L×V堿0.001mol/L×V酸)/(V酸+V堿)
=0.0001mol/L,解得:V酸:V堿=9:1;
(3)Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=3.2×10-11,如果溶液中Qc>Ksp[Mg(OH)2]就能產生沉淀,c(OH-)=![]() =4×10-5 mol/L,則(H+)=2.5×10-10mol/L,所以pH=9.6;
=4×10-5 mol/L,則(H+)=2.5×10-10mol/L,所以pH=9.6;
II.(1)酸根離子水解顯堿性,導致鹽堿地產生堿性,水解離子反應為CO32-+H2O![]() HCO3-+OH-,石膏能與碳酸根離子反應,平衡向左移動,OH-濃度降低,降低堿性,石膏電離出的Ca2+與CO32-結合生成更難溶的CaCO3 ,反應方程式為:Na2CO3+CaSO4=Na2SO4+CaCO3;
HCO3-+OH-,石膏能與碳酸根離子反應,平衡向左移動,OH-濃度降低,降低堿性,石膏電離出的Ca2+與CO32-結合生成更難溶的CaCO3 ,反應方程式為:Na2CO3+CaSO4=Na2SO4+CaCO3;
(2)使SOCl2與FeCl36H2O混合并加熱,可得到無水FeCl3,SOCl2與水反應生成的氯化氫會對氯化鋁水解起到抑制作用,反應的化學方程式為:FeCl36H2O+6SOCl2=FeCl3+6SO2↑+12HCl↑。


科目:高中化學 來源: 題型:
【題目】研究碳、氮及其化合物的轉化對于環境的改善有重大意義。
(1)氧化還原法消除NOx的轉化如下:![]()
已知:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol
2NO(g)+O2(g)=2NO(g) △H=-116.2kJ/mol
則反應I的熱化學方程式為________________。
(2)有人設想將CO按下列反應除去:2CO(g)=2C(s)+O2(g) △H>0,請你分析該設想能否實現?______(填“是”或“否”) ,依據是_____________。
(3)一定條件下,CO可與粉末狀的氫氧化鈉作用生成甲酸鈉。已知常溫時,甲酸的電離平衡常數Ka=1.70×10-4。
① 甲酸鈉的水溶液呈堿性,請用離子反應方程式表示其原因___________。
② 向20mL 0.1mol/L的甲酸鈉溶液中滴加10ml 0.1mol/L的鹽酸,混合液呈______性(填“酸”或“堿”),溶液中離子濃度從大到小的順序為______________。
(4)活性炭也可用于處理汽車尾氣中的NO。在2L恒容密閉容器中加入0.1000molNO和2.030mol固體活性炭,生成A、B兩種氣體,在不同溫度下測得平衡體系中各物質的物質的量如下表:

①該反應的正反應為________(填”吸熱”或“放熱”)反應。
② 200℃時,平衡后向恒容容器中再充入0.1molNO,再次平衡后,NO的百分含量將_____。(填“增大”、“減小”或“不變”)。
③計算反應體系在335℃ 時的平衡常數_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一氧化碳是一種用途相當廣泛的化工基礎原料。
⑴.利用下列反應可以將粗鎳轉化為純度達99.9%的高純鎳。
Ni(s)+4CO(g)![]() Ni(CO)4(g) 該反應的ΔH_______0(選填“>”或“=”或“<”)。
Ni(CO)4(g) 該反應的ΔH_______0(選填“>”或“=”或“<”)。
⑵.在高溫下一氧化碳可將二氧化硫還原為單質硫。已知:
C(s)+O2(g)=CO2(g);ΔH1=-393.5 kJ·mol-1
CO2(g)+C(s)=2CO(g);ΔH2=+172.5 kJ·mol-1
S(s)+O2(g)=SO2(g);ΔH3=-296.0 kJ·mol-1
則2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH4=________。
⑶.工業上一般采用CO與H2反應合成可再生能源甲醇,反應如下:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
某溫度下,將2molCO和6molH2充入2L的密閉容器中,充分反應達到平衡后,測
得c(CO)=0.2mol·L-1,則CO的轉化率為___________。
合成氣經壓縮升溫后進入10m3甲醇合成塔,在催化劑作用下,通過反應進行甲醇合成,T1℃下此反應的平衡常數為160。此溫度下,在密閉容器中加入一定量CO和H2,反應到某時刻測得各組分的濃度如下:
物質 | H2 | CO | CH3OH |
濃度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
比較此時正、逆反應速率的大小:v正_______v逆 (填“>”、“<”或“=”);若其他條件不變,在T2℃反應10min后達到平衡,c(H2)=0.4 mol·L-1,則該時間內反應速率:
v(CH3OH) =__________;
(4)金屬氧化物被一氧化碳還原生成金屬單質和二氧化碳。下圖是四種金屬氧化物被一氧化碳還原時lg[c(CO)/c(CO2)]與溫度(t)的關系曲線圖。800℃時,其中最易被還原的金屬氧化物是____(填化學式),該反應的平衡常數數值(K)等于____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】新型鎂合金被大量應用于制成筆記本電腦外殼、競賽自行車框架等,這說明鎂合金具有的優異性能是
①熔點低 ②硬度大 ③延展性好 ④導電性強 ⑤密度小 ⑥耐腐蝕
A. ①②③ B. ②③④
C. ①③⑥ D. ②⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國目前大多數工廠以鉻鐵礦(主要成份為 FeO·Cr2O3,還含有Al2O3、MgO等雜質)為主要原料生產二水合重鉻酸鈉(Na2Cr2O7·2H2O),其主要工藝流程如下圖所示。 步驟①中涉及的主要反應是:
4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2。
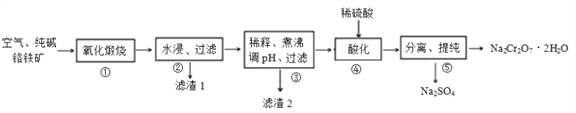
回答下列問題:
(1)二水合重鉻酸鈉(Na2Cr2O7·2H2O)中Cr的化合價為 ______, 氧化煅燒時將鉻鐵礦粉碎的目的是 ____________。
(2)①中雜質 Al2O3 與純堿反應轉變為可溶性鹽,寫出 Al2O3與純堿反應的化學方程式________,濾渣1的主要成分為MgO和_______( 填化學式) 。
(3)濾渣2的成分是___________( 填化學式) 。
(4)步驟④,向濾液中加入稀硫酸,溶液由黃色變為橙色,得到Na2Cr2O7和 Na2SO4的混合溶液,發生反應的離子方程式為__________。
(5)該工藝的酸性廢液中含有Cr2O72-,向廢液中加入綠礬(FeSO4·7H2O)還原處理,反應的離子方程式是__________; 再向處理后的溶液中加入石灰水,使 c(Cr3+)降至10-5mol/L, 此時溶液的pH值為 ______(已知:該條件下,Ksp[Cr(OH)3]=1.0×10-32)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于材料的說法中,正確的是( )
A.光導纖維是信息社會必不可少的有機合成材料
B.棉布、羊毛和滌綸燃燒后都只生成二氧化碳和水
C.航天飛機上的陶瓷防護片屬于新型無機非金屬材料
D.食品保鮮膜、塑料水杯等生活用品的主要成分是聚氯乙烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A.向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
B.已知Ka(HClO)>Ka2(H2CO3),則有:2ClO-+CO2(少量)+H2O===CO![]() +2HClO
+2HClO
C.金溶于王水生成AuCl![]() 離子和NO:Au+4H++4Cl-+NO
離子和NO:Au+4H++4Cl-+NO![]() ===AuCl
===AuCl![]() +NO↑+2H2O
+NO↑+2H2O
D.用NaClO溶液吸收過量的SO2:ClO-+SO2+H2O===HSO![]() +HClO
+HClO
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com