
【題目】乙二醛(OHC–CHO)是重要的精細化工產品。工業上電解乙二醛和鹽酸的混合液制備乙醛酸(OHC–COOH)的裝置如圖所示,通電后,陽極產物將乙二醛氧化為乙醛酸。下列說法錯誤的是()
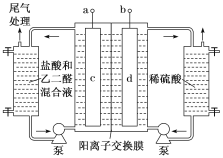
A.a為電源的正極,c電極反應式為2Cl–-2e–=Cl2
B.當1mol乙二醛氧化成1mol乙醛酸時,陰極生成22.4L(標準狀況)氣體
C.電解過程中稀H2SO4電解液的濃度保持不變
D.陽極液中鹽酸的作用有生成氧化劑、增強溶液導電性、提供離子平衡陰極區電荷
【答案】B
【解析】
由題中信息:通電后,陽極產物將乙二醛氧化為乙醛酸。結合題中裝置圖,可知正極生成的Cl2通入盛放鹽酸和乙二醛混合液一側,Cl2與乙二醛發生氧化還原反應,生成Cl-移向c電極,d電極發生還原反應,生成H2,a為電源正極,b為電源負極。根據電解原理,可知陽極發生的電極反應式為:2Cl–-2e-=Cl2↑,陰極發生還原反應,電極反應方程式為:2H+-2e-=H2↑。據此進行分析。
A.由分析可知,c電極為陽極,發生氧化反應,則與c電極直接相連的a為電源的正極,c電極的電極反應式為:2Cl–-2e-=Cl2↑,A項正確;
B.當1mol乙二醛氧化成1mol乙醛酸時,即OHC-CHO~OHC-COOH~2e-~Cl2,參加反應的Cl2是1mol,由圖像可知,一部分Cl2以尾氣形式排出,一部分Cl2溶于水而損耗,故生成的Cl2應大于1mol,根據電子得失守恒,陰極產生的H2的物質的量也應大于1mol,在標準狀況下的體積應大于22.4L,B項錯誤;
C.陰極即d電極反應式為2H++2e-=H2↑,電解過程中左側的H+通過陽離子交換膜進入陰極,相當于右側的電解液中任何物質都不參與電極反應,所以電解過程中稀H2SO4電解液的濃度保持不變,C項正確;
D.陽極液中鹽酸的作用:產生氯氣氧化乙二醛生成乙醛酸,提供離子增強溶液導電性、提供氫離子移向陰極平衡陰極區電解液電荷,D項正確;
答案選B。


 小學學習好幫手系列答案
小學學習好幫手系列答案 小學同步三練核心密卷系列答案
小學同步三練核心密卷系列答案科目:高中化學 來源: 題型:
【題目】在一定條件下可實現下圖所示物質之間的轉化:
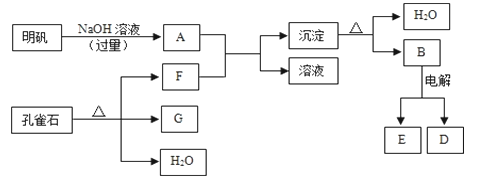
請填寫下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(堿式碳酸銅),受熱易分解,圖中的F是______(填化學式)。
(2)寫出明礬溶液與過量NaOH溶液反應的離子方程式:_________________。
(3)圖中所得G和D都為固體,混合后在高溫下可發生反應,寫出該反應的化學方程式_______,該反應消耗了3 molG,則轉移的電子數是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設 NA 表示為阿伏加德羅常數,下列敘述中,正確的是( )
A.常溫常壓下,16 g O2和O3的混合物中共含有NA個氧原子
B.假設1 mol氯化鐵完全轉化為氫氧化鐵膠體,則分散系中膠體微粒數為NA
C.78 g Na2O2 固體中所含陰、陽離子總數為4NA
D.在銅與硫有反應中,1 mol銅原子參加反應失去的電子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活、社會息息相關,下列說法錯誤的是( )
A.血液透析是膠體的化學性質,“人工腎”利用血液透析原理救治危重新冠肺炎患者
B.漂白粉是一種常用殺菌消毒劑,其主要成分是氯化鈣和次氯酸鈣
C.“用濃酒和糟入甑(蒸鍋),蒸氣令上……”,其中涉及的操作是蒸餾
D.醫用口罩無紡布的原材料成分之一是聚丙烯,其結構簡式為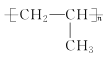
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列裝置進行有關實驗不能達到預期目的的是( )
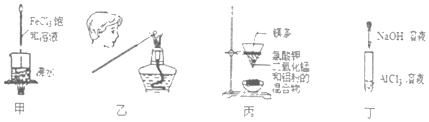
A.用甲裝置可制得Fe(OH)3膠體
B.用乙裝置確定所蘸取的物質中含有鉀元素
C.用丙裝置制少量金屬錳
D.用丁裝置觀察Al(OH)3能溶于NaOH溶液中
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~L分別表示中學化學中常見的一種物質,其中A、G為常見的金屬單質,K、L為氣體,K能使濕潤的紅色石蕊試紙變藍,M由兩種元素組成,其質量比8:1。
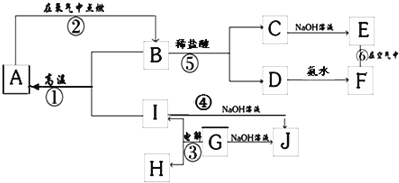
(1)K的電子式為_____
(2)反應②的離子方程式:_____,反應③的離子方程式:_____
(3)反應④的化學方程式:_____,反應⑥的化學方程式_____
(4)已知A和K反應為置換反應,則M的化學式為_____
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定溫度下,向a L密閉容器中加入1mol X氣體和2mol Y氣體,發生如下反應:X(g)+2Y(g)![]() 2Z(g),此反應達到平衡的標志是( )
2Z(g),此反應達到平衡的標志是( )
A. 容器內密度不隨時間變化B. 容器內各物質的濃度不隨時間變化
C. 容器內X、Y、Z的濃度之比為1∶2∶2D. 單位時間消耗0.1mol X同時生成0.2mol Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為從粗食鹽水中除去Ca2+、Mg2+、SO42-等離子,以制得精鹽水。某同學設計如下方案:
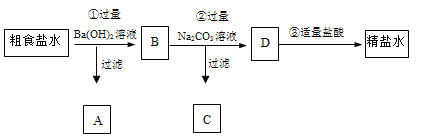
以下說法正確的是( )
A.A中主要有Mg(OH)2和BaSO4,也可能有一些Ca(OH)2
B.②中加入過量Na2CO3溶液的主要目的是為了除去Mg2+、Ca2+
C.D中有CO32-、Cl- 、Na+ 這3種離子
D.③中發生的反應只有2H++CO32-= H2O +CO2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】取一張用飽和的NaCl溶液浸濕的pH試紙,兩根鉛筆芯作電極,接通直流電源,一段時間后,發現b電極與試紙接觸處出現一個雙色同心圓,內圈為白色,外圈呈淺紅色。則下列說法錯誤的是( )
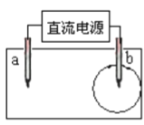
A. 電解過程中b電極產生氯氣
B. a電極是陰極
C. b電極與電源的正極相連接
D. a電極附近溶液的pH變小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com