
【題目】在一密閉容器中,反應3A(g)+B(s)![]() 2C(g)+2D(g) ΔH >0達到平衡后,改變以下條件,下列說法正確的是( )
2C(g)+2D(g) ΔH >0達到平衡后,改變以下條件,下列說法正確的是( )
A. 增大壓強,正、逆反應速率同等程度增大,平衡不移動
B. 升高溫度,正反應速率增大,逆反應速率減小,平衡向正方向移動
C. 增加A的濃度,平衡向正方向移動,平衡常數增大
D. 增加B的用量,正、逆反應速率不變,平衡不移動
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】以重晶石(BaSO4)為原料,可按如下工藝生產立德粉(ZnS·BaSO4):
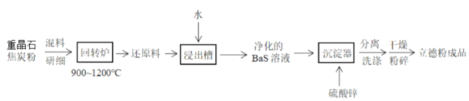
下列說法不正確的是
A.在回轉爐中重晶石被過量焦炭還原為可溶性硫化鋇,該過程的化學方程式為BaSO4+4C![]() BaS+4CO↑
BaS+4CO↑
B.回轉爐尾氣中含有有毒氣體,生產上可通過水蒸氣變換將其轉化為CO2和一種清潔能源氣體,該反應的化學方程式為CO+H2O![]() CO2+H2
CO2+H2
C.在潮濕空氣中長期放置的“還原料”。會逸出臭雞蛋氣味的氣體,且水溶性變差。其原因是“還原料”表面生成了難溶于水的BaSO4
D.沉淀器中發生的離子反應方程式為:S2-+Ba2++Zn2++SO42-=ZnS·BaSO4↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)用如圖裝置做以下兩個實驗:
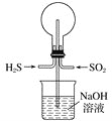
①常溫下將H2S和SO2以物質的量之比為1∶1充滿燒瓶,不久,燒瓶中能觀察到的現象是_______。
②若用Cl2代替SO2,其他條件不變,觀察到的現象與①相同之處為______,不同之處為_____;試用簡要文字和化學方程式解釋原因: ______。
③若想使②中反應后,燒瓶內產生“噴泉”現象,引發的操作為________。
(2)某課外活動小組利用如圖所示裝置進行實驗:
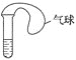
在試管中注入某無色溶液,加熱試管,溶液變為紅色,冷卻后恢復無色,因此溶液可能是_____溶液;加熱時溶液由無色變為紅色的原因是_______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列熱化學方程式中的反應熱,表示燃燒熱的是( )
A. NH3(g)+![]() O2(g)
O2(g)![]()
![]() N2(g)+
N2(g)+![]() H2O(g) ΔH=-a kJ·mol-1
H2O(g) ΔH=-a kJ·mol-1
B. C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
6CO2(g)+6H2O(l) ΔH=-b kJ·mol-1
C. C(s) +H2O(g) == CO(g)+H2(g) H=-c kJ·mol-1
D. CH3CH2OH(l)+![]() O2(g)
O2(g)![]() CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
CH3CHO(l)+H2O(l) ΔH=-d kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,該反應是一個可逆反應,若反應物起始的物質的量相同,下列關于該反應的示意圖不正確的是
A. 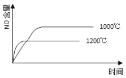
B. 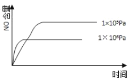
C. 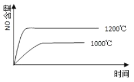
D. 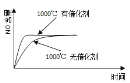
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】綠礬晶體(FeSO4·7H2O,M=278g/mol)是治療缺鐵性貧血藥品的重要成分。實驗室利用硫酸廠的燒渣(主要成分為Fe2O3及少量FeS、SiO2),制備綠礬的過程如下:
 試回答:(1)操作Ⅰ為_____________(填寫操作名稱)。
試回答:(1)操作Ⅰ為_____________(填寫操作名稱)。
(2) 試劑Y與溶液X反應的離子方程式為__________________________________。
(3)檢驗所得綠礬晶體中含有Fe2+的實驗操作是________________________________。
(4)操作Ⅲ的順序依次為:_______________、冷卻結晶、過濾 、__________、干燥。
(5)某同學用酸性KMnO4溶液測定綠礬產品中Fe2+含量:
a.稱取11.5g綠礬產品,溶解,配制成1000mL溶液;
b.量取25.00mL待測溶液于錐形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至終點,消耗KMnO4溶液體積的平均值為20.00mL。
①步驟a配制溶液時需要的玻璃儀器除玻璃棒、量筒、燒杯、膠頭滴管外,還需___________。
②該同學設計的下列滴定方式,最合理的是____________(夾持部分略去)(填字母序號)。
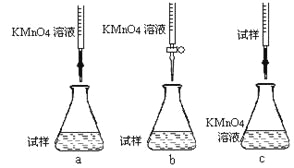
③滴定時發生反應的離子方程式為:_______________________________________。
④判斷此滴定實驗達到終點的方法是_____________________________;若在滴定終點讀取滴定管刻度時,俯視KMnO4溶液液面,其它操作均正確,則使測定結果________(填“偏高”“偏低”“無影響”)。
⑤計算上述樣品中FeSO4·7H2O的質量分數為________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B是中學化學常見的化合物,它們各由兩種元素組成;乙為元素R組成的單質,它們之間存在如圖所示關系。根據要求回答問題:
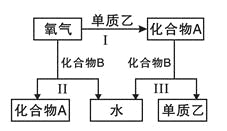
(1)上圖三個反應中,屬于氧化還原反應的有____個。
(2)若元素R與氧同主族,下列事實能說明R與氧的非金屬性相對強弱的有____。
A.還原性:H2R>H2O B.酸性:H2R>H2O
C.穩定性:H2R<H2O D.沸點:H2R<H2O
(3)若化合物B常溫下為氣體,其水溶液呈堿性(答題必須用具體物質表示)。
①化合物B的電子式為______;其水溶液呈堿性的原因是______(用離子方程式表示)。
②化合物B可與O2組成燃料電池(氫氧化鉀溶液為電解質溶液),其反應產物與反應Ⅲ相同。寫出該電池負極的電極反應式______________________。
③當1mol的化合物B分別參與反應Ⅱ、Ⅲ時,熱效應為△H1和△H2,則反應Ⅰ的熱化學方程式為______________(注:反應條件相同、所有物質均為氣體)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鈦(Ti)是一種具有許多優良性能的金屬,鈦和鈦合金被認為是21世紀的重要金屬材料。
(1)Ti(BH4)2是一種過渡元素硼氫化物儲氫材料。
①Ti2+基態電子排布式可表示為_____。
②與BH4-互為等電子體的陽離子的化學式為_____。
③H、B、Ti原子的第一電離能由小到大的順序為_____。
(2)二氧化鈦(TiO2)是常用的、具有較高催化活性和穩定性的光催化劑,常用于污水處理。納米TiO2催化的一個實例如圖所示。
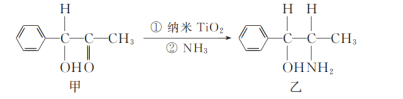
化合物乙的分子中采取sp3雜化方式的原子個數為_____。
(3)水溶液中并沒有[Ti(H2O)6)]4+離子,而是[Ti(OH)2(H2O)4]2+離子,1mol[Ti(OH)2(H2O)4]2+中σ鍵的數目為____。
(4)氮化鈦(TiN)具有典型的NaCl型結構,某碳氮化鈦化合物,結構是用碳原子取代氮化鈦晶胞(結構如圖)頂點的氮原子,則此碳氮化鈦化合物的化學式是_____。
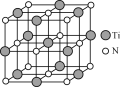
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗中,能達到實驗目的的是
A. 實驗室制取氨氣
實驗室制取氨氣
B.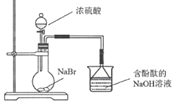 燒杯中紅色褪去能證明生成HBr
燒杯中紅色褪去能證明生成HBr
C. 實驗室制取氧氣
實驗室制取氧氣
D.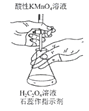 用酸性KMnO4溶液滴定HCO4溶液
用酸性KMnO4溶液滴定HCO4溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com