
【題目】能在溶液中大量共存的一組離子是( )
A.Ag+、SO42﹣、Cl﹣
B.Fe2+、H+、NO3﹣
C.K+、Na+、NO3﹣
D.Mg2+、SO42﹣、CO32﹣
科目:高中化學 來源: 題型:
【題目】若甲烷與氯氣以物質的量之比1:1混合,在光照下得到的有機取代產物是( ) ①CH3Cl、②CH2C12、③CHCl3、④CCl4 .
A.只有①
B.只有③
C.①②③的混合物
D.①②③④的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于分散系的敘述不正確的是( )

A. 分散系的分類:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3膠體,可以加以區分
C. 把FeCl3飽和溶液滴入到氫氧化鈉溶液中,以制取Fe(OH)3膠體
D. 如圖顯示的是樹林的晨曦,該現象與丁達爾效應有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:反應①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1 , 平衡常數為K1 , 反應②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2 , 平衡常數為K2 ,
在不同溫度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)從上表可推斷,反應Q10(填“>”或“<”).
(2)現有反應③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常數為K3 . 根據反應①與②推導出K1、K2、K3的關系式K3= , Q1、Q2、Q3的關系式Q3= , 可推斷反應③是(填“放”或“吸”)熱反應.
(3)要使反應③在一定條件下建立的平衡右移,可采取的措施有 .
A.縮小容器體積
B.擴大容器的體積
C.降低溫度E.升高溫度
D.使用合適的催化劑
(4)如圖甲、乙表示反應③在t1時刻達到平衡,在t2時刻因改變某個條件而發生變化的情況: 圖甲中t2時刻改變的條件可能是 , 圖乙中t2時刻改變的條件可能是 . 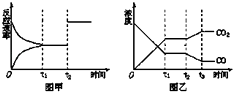
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質在水中的電離方程式書寫錯誤的是
A.CaCl2=Ca2++2Cl-B.Ba(OH)2=Ba2++OH2-
C.KOH=K++OH-D.H2SO4=2H++SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在80℃時,將0.4mol的四氧化二氮氣體充入2L已抽空的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:反應進行至100s后將反應混合物的溫度降低,發現氣體的顏色變淺.
時間(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)該反應的化學方程式為 , 表中bc(填“<”、“=”、“>”).
(2)20s時,N2O4的濃度為mol/L,0~20s內N2O4的平均反應速率為 .
(3)該反應的平衡常數表達式K= , 在80℃時該反應的平衡常數K值為(保留2位小數).
(4)在其他條件相同時,該反應的K值越大,表明建立平衡時 . A、N2O4的轉化率越高 B、NO2的產量越大
C、N2O4與NO2的濃度之比越大 D、正反應進行的程度越大.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示在密閉容器中反應:2SO2+O22SO3+Q達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況,a b過程中改變的條件可能是;bc過程中改變的條件可能是; 若增大壓強時,反應速度變化情況畫在c~d處 . 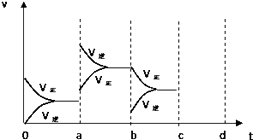
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A~E為中學常見的物質,有如圖所示轉化關系,已知A為金屬單質。請回答:

(1)A的化學式為________。
(2)在B的溶液中加入NaOH溶液后可觀察到的現象為_________。C轉變為D的化學方程式為_____________。
(3)向E溶液中加入A時發生反應的離子方程式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對于可逆反應A(g)+3B(g)2C(g)+2D(g),在不同條件下的化學反應速率如下,其中表示的反應速率最快的是( )
A.v(A)=0.5 molL﹣1min﹣1
B.v(B)=1.2 molL﹣1s﹣1
C.v(D)=0.4 molL﹣1min﹣1
D.v(C)=0.1 molL﹣1s﹣1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com