
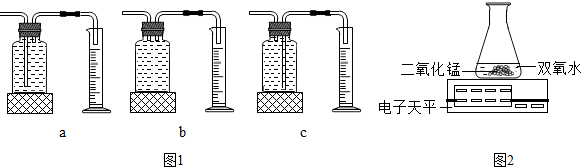
| 實驗次數 | 雙氧水的質量 | 雙氧水的濃度 | MnO2質量 | 相同時間內產生氧氣的體積(反應均未結束) |
| 1 | 50.0克 | 1% | 0.1 | 9毫升 |
| 2 | 50.0克 | 2% | 0.1 | 16毫升 |
| 3 | 50.0克 | 4% | 0.1 | 31毫升 |
分析 (1)根據雙氧水在二氧化錳的催化作用下生成水和氧氣以及不同的實驗裝置,功能不同進行解答;
(2)根據表中提供的數據可以判斷影響雙氧水分解速率的因素;
(3)根據單位時間內,電子天平的質量示數減少的越快,說明反應速率越快進行解答.
解答 解:(1)雙氧水在二氧化錳的催化作用下生成水和氧氣,反應的化學方程式為:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
圖1裝置中的c裝置中,氧氣通過左邊導管進入瓶中,由于氧氣不易溶于水,把水壓入量筒中,量筒中收集的水的體積即為反應生成氧氣的體積,因此本實驗中,應選用圖1裝置中的c來測量氧氣的體積.
故填:c.
(2)分析該實驗數據可得:在雙氧水和二氧化錳的質量相同的情況下,雙氧水濃度越高,相同時間內產生氧氣的體積越多,即在相同條件下,雙氧水濃度越高,分解得越快.
故填:濃度越高.
(3)乙同學用圖2裝置也可進行甲同學的實驗,他通過比較單位時間內電子天平的質量示數減少的多少來確定雙氧水分解的快慢,即單位時間內電子天平的質量示數減少的越快,氧氣產生的越多,雙氧水分解的越快.
故填:單位時間內電子天平的質量示數減少的多少.
點評 合理設計實驗,科學地進行實驗、分析實驗,是得出正確實驗結論的前提,因此要學會設計實驗、進行實驗、分析實驗,為學好化學知識奠定基礎.


科目:初中化學 來源: 題型:解答題
查看答案和解析>>
科目:初中化學 來源: 題型:實驗探究題
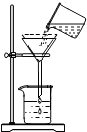 保護水土資源人人有責,為了測定一定量黃河水中泥沙的質量,某同學設計了如圖所示的實驗操作:
保護水土資源人人有責,為了測定一定量黃河水中泥沙的質量,某同學設計了如圖所示的實驗操作:查看答案和解析>>
科目:初中化學 來源: 題型:填空題
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
| 實驗序號 | 過氧化氫溶液濃度/% | 過氧化氫溶液體積/ml | 溫度/℃ | 二氧化錳的用量/g | 收集氧氣的體積/ml | 反應所需的時間/S |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 12 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 2 | 49.21 | |
| ④ | 30 | 5 | 55 | 2 | 10.76 |
查看答案和解析>>
科目:初中化學 來源: 題型:填空題
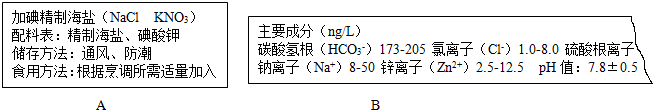
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com