
【題目】1-溴丙烷是一種重要的有機合成中間體,沸點為71℃,密度為1.36g.cm-3。實驗室制備少量1-溴丙烷的主要步驟如下:
步驟1:在儀器A中加入攪拌磁子、12g正丙醇及20mL水,冰水冷卻下緩慢加入28mL濃H2SO4;冷卻至室溫,攪拌下加入24gNaBr。
步驟2:如上圖所示搭建實驗裝置,緩慢加熱,直到無油狀物餾出為止。
步驟3:將餾出液轉入分液漏斗,分出有機相。
步驟4:將分出的有機相轉入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗滌,分液,得粗產品,進一步提純得1-溴丙烷。

(1)儀器A、B的名稱分別是____________________ 、______________________。
(2)反應時生成的主要有機副產物有_______________。(寫出兩種物質的結構簡式)
(3)步驟2中需向接受瓶內加入少量冰水并置于冰水浴中的目的是_____________。
(4)寫出生成1-溴丙烷的化學方程式_______________________________________。
【答案】 蒸餾燒瓶 冷凝管 CH3CH=CH2,CH3CH2 CH2OCH2CH2CH3,CH3CHBrCH3 減少1—溴丙烷的揮發 CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O
CH3CH2CH2Br + H2O
【解析】(1)根據常見儀器的結構可知,儀器A、B的名稱分別是蒸餾燒瓶、冷凝管;
(2)正丙醇在濃硫酸作用下可能發生消去反應,或分子間取代反應,則反應時生成的主要有機副產物有2-溴丙烷和丙烯、正丙醚,它們的結構簡式分別是CH3CHBrCH3CH3CH=CH2CH3、CH2CH2OCH2CH2CH3;
(3)步驟2中需緩慢加熱使反應和蒸餾平穩進行,目的是減少HBr揮發;
(4)生成1-溴丙烷的化學方程式為CH3CH2CH2OH + HBr ![]() CH3CH2CH2Br + H2O。
CH3CH2CH2Br + H2O。


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:
【題目】Ⅰ.煤制天然氣的工藝流程簡圖如下:
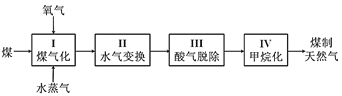
(1)反應Ⅰ:C(s) + H2O(g)![]() CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧氣會與部分碳發生燃燒反應。請利用能量轉化及平衡移動原理說明通入氧氣的作用:___________________________。
CO(g) + H2(g) ΔH =+135 kJ·mol1,通入的氧氣會與部分碳發生燃燒反應。請利用能量轉化及平衡移動原理說明通入氧氣的作用:___________________________。
(2)反應Ⅱ:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH=41 kJ·mol1。如圖表示不同溫度條件下,煤氣化反應Ⅰ發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系。
CO2(g) + H2(g) ΔH=41 kJ·mol1。如圖表示不同溫度條件下,煤氣化反應Ⅰ發生后的汽氣比(水蒸氣與CO物質的量之比)與CO平衡轉化率的變化關系。
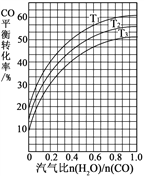
①判斷T1、T2和T3的大小關系:______________。(從小到大的順序)
②若煤氣化反應Ⅰ發生后的汽氣比為0.8,經煤氣化反應Ⅰ和水氣變換反應Ⅱ后,得到CO與H2的物質的量之比為1∶3,則反應Ⅱ應選擇的溫度是_______(填“T1”或“T2”或“T3”)。
(3)①甲烷化反應Ⅳ發生之前需要進行脫酸反應Ⅲ。煤經反應Ⅰ和Ⅱ后的氣體中含有兩種酸性氣體,分別是H2S和_______。
②工業上常用熱碳酸鉀溶液脫除H2S氣體得到兩種酸式鹽,該反應的離子方程式是__________。
Ⅱ.利用甲烷超干重整CO2技術可得到富含CO的氣體,將甲烷和二氧化碳轉化為可利用的化學品,在能源和環境上的意義重大。該技術中的化學反應為:
CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0
2H2O(g)+4CO(g) ΔH>0
CH4超干重整CO2的催化轉化原理示意如圖:
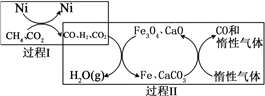
(4)過程Ⅱ,實現了含氫物種與含碳物種的分離。生成H2O(g)的化學方程式是______________。
(5)假設過程Ⅰ和過程Ⅱ中的各步均轉化完全,下列說法正確的是_______。((填序號)
a.過程Ⅰ和過程Ⅱ中均含有氧化還原反應
b.過程Ⅱ中使用的催化劑為Fe3O4和CaCO3
c.若過程Ⅰ投料![]() =1,可導致過程Ⅱ中催化劑失效
=1,可導致過程Ⅱ中催化劑失效
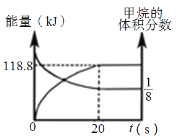
(6)一定條件下,向體積為2 L的恒容密閉容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),發生反應CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0,實驗測得,反應吸收的能量和甲烷的體積分數隨時間變化的曲線圖像如圖。計算該條件下,此反應的ΔH=________________。
2H2O(g)+4CO(g) ΔH>0,實驗測得,反應吸收的能量和甲烷的體積分數隨時間變化的曲線圖像如圖。計算該條件下,此反應的ΔH=________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去粗鹽中的CaCl2、MgCl2、Na2SO4 以及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):
(1)判斷BaCl2已過量的方法是___________________________________。
(2)第④步中,相關的離子方程式是_______________________________。
(3)為檢驗精鹽純度,需配230mL0.2mol/L NaCl(精鹽)溶液,則需用托盤天平稱取精鹽固體的質量為_______g。
(4) 配制NaCl(精鹽)溶液時需用容量瓶,其在使用前必須______ 。
(5) 配制NaCl(精鹽)溶液時,若出現下列操作,其結果偏高的是__________
A.稱量時NaCl已潮解 B.天平的砝碼已銹蝕
C.定容搖勻后,液面下降又加水 D.定容時俯視刻度線
(6)將已配制好的濃度為C1 mol·L-1NaCl溶液與等質量的水混合后,此時溶液的濃度為C2 mol·L-1 ,則C1 與C2二者的關系為______。
A. C1=2C2 B.C1<2C2 C.C1>2C2 D.2C1<C2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A的結構簡式如圖所示:下列有關A的性質敘述中,錯誤的是

A. 與金屬鈉完全反應時,兩者物質的量之比為1:3
B. 與氫氧化鈉完全反應時,兩者物質的量之比為1:1
C. 與碳酸氫鈉溶液反應時,兩者物質的量之比為1:2
D. 在一定條件下,既能與羧酸反應,又能與醇反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Na2O2具有強氧化性,H2具有還原性,某同學根據氧化還原反應的知識推測Na2O2與H2能發生反應。為了驗證此推測結果,該同學設計并進行如下實驗。
I.實驗探究

步驟1:按如圖所示的裝置組裝儀器(圖中夾持儀器已省略)并檢查裝置的氣密性,然后裝入藥品。
步驟2:打開K1、K2,在產生的氫氣流經裝有Na2O2的硬質玻璃管的過程中,未觀察到明顯現象。
步驟3:進行必要的實驗操作,淡黃色的粉末慢慢變成白色固體,無水硫酸銅未變藍色。
(1)組裝好儀器后,要檢查裝置的氣密性。簡述檢查虛線框內裝置氣密性的方法:________。
(2)B裝置中所盛放的試劑是_____,其作用是_______。
(3)步驟3中的必要操作為打開K1、K2,_______(請按正確的順序填入下列步驟的字母)。
A.加熱至Na2O2逐漸熔化,反應一段時間
B.用小試管收集氣體并檢驗其純度
C.關閉K1
D.停止加熱,充分冷卻
(4)由上述實驗可推出Na2O2與H2反應的化學方程式為__________。
II.數據處理
(5)實驗結束后,該同學欲測定C裝置硬質玻璃管內白色固體中未反應完的Na2O2含量。
其操作流程如下:
![]()
①測定過程中需要的儀器除固定、夾持儀器外,還有電子天平、燒杯、酒精燈、蒸發皿和____。
②在轉移溶液時,若溶液轉移不完全,則測得的Na2O2質量分數_____(填“偏大”“偏小”或“不變”)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 第ⅠA 族元素的金屬性比第ⅡA 族元素的金屬性強
B. 第ⅦA 族元素單質的熔點從上到下逐漸升高
C. 第ⅥA 族元素的氫化物中,穩定性最好的元素非金屬性最弱
D. 第三周期元素的離子半徑從左到右逐漸減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳在金屬羰基化合物(金屬元素和CO中性分子形成的一類配合物)、金屬儲氫材料(能可逆地多次吸收、儲存和釋放H2的合金)等領域用途廣泛。
(1)基態Ni原子核外電子排布式為__________________________。
(2)Ni(CO)4中鎳元素的化合價為__________,寫出與CO互為等電子體的帶一個單位正電荷的陽離子為:_______。Ni(CO)4的一氯代物有2種,其空間構型為_______________ o
(3)一種儲氫合金由鎳與鑭(La)組成,其晶胞結構如圖所示,則該晶體的化學式為_____________

(4)下列反應常用來檢驗Ni2+,請寫出另一產物的化學式:_______________。

與Ni2+配位的N原子有__________個,該配合物中存在的化學鍵有_________(填序號)。
A.共價鍵 B.離子鍵 C.配位鍵 D.金屬鍵 E.氫鍵
(5)Ni與Fe的構型相同(體心立方堆積),Ni的摩爾質量為M g/mol,阿伏加德羅常數為NA,密度為a g/cm3Ni原子的半徑為_________pm(金屬小球剛性相切)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com