
某礦樣含有大量的CuS及少量其它不溶于酸的雜質(zhì)。實驗室中以該礦樣為原料制備CuCl2·2H2O晶體,流程如下: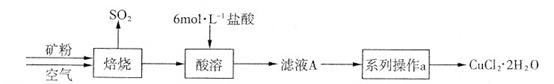
(1)在實驗室中,欲用37%(密度為1.19 g·mL-1)的鹽酸配制500 mL 6 mol·L-1的鹽酸,需要的儀器除量筒、燒杯、玻璃棒外,還有 、 。
(2)①若在實驗室中完成系列操作a。則下列實驗操作中,不需要的是 (填下列各項中序號)。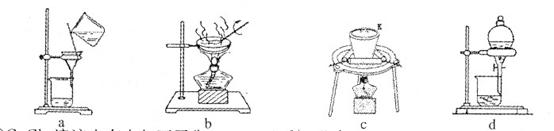
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(藍色)+4Cl- CuCl42-(黃色)+4H2O。
CuCl42-(黃色)+4H2O。
欲用實驗證明濾液A(綠色)中存在上述平衡,除濾液A外,下列試劑中,還需要的是 (填下列各項中序號)。
a.FeCl3固體 b.CuCl2固體 c.蒸餾水
(3)某化學小組欲在實驗室中研究CuS焙燒的反應過程,查閱資料得知在空氣條件下焙燒CuS時,固體質(zhì)量變化曲線及SO2生成曲線如下圖所示。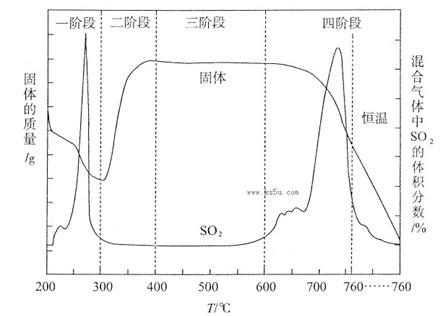
①CuS礦樣在焙燒過程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,轉(zhuǎn)化順序為:
第①步轉(zhuǎn)化主要在200~300oC范圍內(nèi)進行,該步轉(zhuǎn)化的化學方程式為 。
②300~400oC范圍內(nèi),固體質(zhì)量明顯增加的原因是 ,上圖所示過程中,CuSO4固體能穩(wěn)定存在的階段是 (填下列各項中序號)。
a.一階段 b、二階段 c、三階段 d、四階段
③該化學小組設(shè)計如下裝置模擬CuS礦樣在氧氣中焙燒第四階段的過程,并驗證所得氣體為SO2和O2的混合物。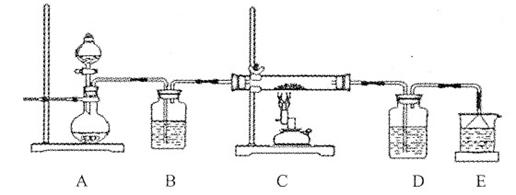
a.裝置組裝完成后,應立即進行的一項操作是 。
b.當D裝置中產(chǎn)生白色沉淀時,便能說明第四階段所得氣體為SO2和O2的混合物。你認為裝置D中原來盛有的溶液為 溶液。
c.若原CuS礦樣的質(zhì)量為l0.0 g,在實驗過程中,保持溫度在760oC左右持續(xù)加熱,待礦樣充分反應后,石英玻璃管內(nèi)所得固體的質(zhì)量為8.0 g,則原礦樣中CuS的質(zhì)量分數(shù)為 。
(1)(4分)膠頭滴管(2分) 500mL容量瓶(2分)
(2)(4分)①cd(2分)②c(2分)
(3)(12分)①2CuS+O2=Cu2S+SO2(2分)②Cu2S轉(zhuǎn)化為CuSO4(2分) c(2分)
③a.檢驗裝置的氣密性(2分) b.氯化鋇(BaCl2)(2分) c.96%(2分)
解析試題分析:(1)由濃鹽酸配制稀鹽酸,需要的儀器除量筒、燒杯、玻璃棒外,還需要:膠頭滴管、500mL容量瓶。
(2)①由CuCl2溶液制取CuCl2?2H2O,需要進行蒸發(fā)濃縮、降溫結(jié)晶,然后過濾可得CuCl2?2H2O晶體,所以不需要c、d操作。
②FeCl3溶液為黃色,CuCl2溶液為藍色,對原平衡體系溶液的顏色產(chǎn)生干擾,而加入蒸餾水可使平衡向逆反應方向移動,溶液的顏色發(fā)生改變,可證明濾液A(綠色)中存在上述平衡,故c項正確。
(3)①根據(jù)流程圖CuS與O2反應生成Cu2S,還應生成SO2,化學方程式為:2CuS+O2=Cu2S+SO2
②第②步轉(zhuǎn)化,由Cu2S轉(zhuǎn)化為CuO?CuSO4,所以300~400oC范圍內(nèi),固體質(zhì)量明顯增加的原因是Cu2S轉(zhuǎn)化為CuSO4;第二階段生成了CuSO4,第四階段固體質(zhì)量減小,CuSO4發(fā)生了分解反應,所以CuSO4固體能穩(wěn)定存在的階段是第三階段。
③a.實驗裝置組裝完后應首先檢驗裝置的氣密性;b. SO2與BaCl2不反應,SO2、O2與BaCl2溶液反應可以生成BaSO4沉淀,所以裝置D中原來盛有的溶液為BaCl2溶液;c. 礦樣充分反應后,石英玻璃管內(nèi)所得固體CuO,根據(jù)Cu元素質(zhì)量守恒,可知CuS ~ CuO ,所以CuS的質(zhì)量為8g÷80g/mol×96g/mol=9.6g,則原礦樣中CuS的質(zhì)量分數(shù)為:9.6g÷10.0g×100%=96%
考點:本題考查基本儀器、基本操作、化學平衡、化學方程式的書寫、化學計算。


科目:高中化學 來源: 題型:問答題
(14分)鐵、鋁、銅、硅及其合金材料在生產(chǎn)生活中有著廣泛的應用。請回答下列有關(guān)問題。
(1)目前已冶煉出純度達99.9999%的鐵。下列關(guān)于純鐵的敘述錯誤的是
(填字母)。
| A.硬度比鋼小,熔點比鋼高 | B.不能與鹽酸反應 |
| C.與不銹鋼成分相同 | D.在冷的濃硫酸中鈍化 |
 6Cu+SO2↑,該反應的氧化劑是
6Cu+SO2↑,該反應的氧化劑是 
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某小組通過實驗研究Na2O2與水的反應?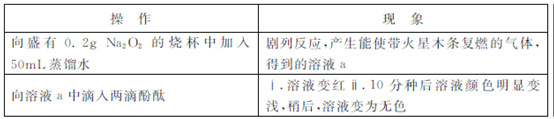
(1)Na2O2與水反應的化學方程式是 ?
(2)ⅱ中溶液褪色可能是溶液a中存在較多的H2O2,H2O2與酚酞發(fā)生了反應?
Ⅰ.甲同學通過實驗證實了H2O2的存在:取少量溶液a,加入試劑 (填化學式),有氣體產(chǎn)生?
Ⅱ.乙同學查閱資料獲悉:用KMnO4(被還原為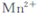 )可以測定H2O2的含量?
)可以測定H2O2的含量?
取3mL溶液a稀釋至15mL,用稀H2SO4酸化,再逐滴加入0.0045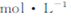 KMnO4溶液,產(chǎn)生氣體,溶液褪色速率開始較慢后變快,至終點時共消耗10mL KMnO4溶液?
KMnO4溶液,產(chǎn)生氣體,溶液褪色速率開始較慢后變快,至終點時共消耗10mL KMnO4溶液?
①KMnO4與H2O2反應的離子方程式是 ?
②溶液a中 ?
?
③溶液褪色速率開始較慢后變快的原因可能是 ?
(3)為探究現(xiàn)象ⅱ產(chǎn)生的原因,同學們繼續(xù)進行了如下實驗:
Ⅰ.向H2O2溶液中滴入兩滴酚酞,振蕩,加入5滴0.1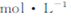 NaOH溶液,溶液變紅又迅速變無色且產(chǎn)生氣體,10分鐘后溶液變無色,該過程無明顯熱效應?
NaOH溶液,溶液變紅又迅速變無色且產(chǎn)生氣體,10分鐘后溶液變無色,該過程無明顯熱效應?
Ⅱ.向0.1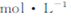 NaOH溶液中滴入兩滴酚酞的,振蕩,溶液變紅,10分鐘后溶液顏色無明顯變化;向該溶液中通入氧氣,溶液顏色無明顯變化?從實驗Ⅰ和Ⅱ中,可得出的結(jié)論是 ?
NaOH溶液中滴入兩滴酚酞的,振蕩,溶液變紅,10分鐘后溶液顏色無明顯變化;向該溶液中通入氧氣,溶液顏色無明顯變化?從實驗Ⅰ和Ⅱ中,可得出的結(jié)論是 ?
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
某研究性學習小組在網(wǎng)上收集到信息:鈉、鎂等活潑金屬都能在CO2氣體中燃燒。他們對鈉在CO2氣體中燃燒后得到的白色產(chǎn)物進行了如下探究:
【實驗操作】將燃燒的鈉迅速伸入裝滿CO2的集氣瓶中,鈉在其中繼續(xù)燃燒,反應后冷卻,瓶底有黑色顆粒,瓶壁上附著白色物質(zhì)。
【提出假設(shè)】
假設(shè)1:白色物質(zhì)是Na2O。
假設(shè)2:白色物質(zhì)是Na2CO3。
假設(shè)3:白色物質(zhì)是Na2O和Na2CO3的混合物。
【設(shè)計方案】該小組對燃燒后生成的白色物質(zhì)進行如下探究:
| 實驗方案 | 實驗操作 | 實驗現(xiàn)象 | 結(jié)論 |
| 方案1 | 取少量白色物質(zhì)于試管中,加入適量水,振蕩,樣品全部溶于水,向其中加入無色酚酞試液 | 溶液變成紅色 | 白色物質(zhì)為Na2O |
| 方案2 | ①取少量白色物質(zhì)于試管中,加入適量水,振蕩,樣品全部溶于水,向其中加入過量的CaCl2溶液。②靜置片刻,取上層清液于試管中,滴加無色酚酞試液 | ①出現(xiàn)白色沉淀 ②無明顯現(xiàn)象 | 白色物質(zhì)為Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
我國化工專家侯德榜,勇于創(chuàng)新,改進氨堿法設(shè)計了“聯(lián)合制堿法”,為世界制堿工業(yè)作出了突出貢獻。請完成下列問題:
(1)“聯(lián)合制堿法”制得的“堿”是 (填化學式)。
(2)氨堿法和聯(lián)合制堿法是兩大重要的工業(yè)制堿法,下列表達中,不正確的是 。
| | | 氨堿法 | 聯(lián)合制堿法 |
| A | 原料 | 食鹽、氨氣、生石灰 | 食鹽、氨氣、二氧化碳 |
| B | 可能的副產(chǎn)物 | 氯化鈣 | 氯化銨 |
| C | 循環(huán)物質(zhì) | 氨氣、二氧化碳 | 氯化鈉 |
| D | 評價 | 原料易得;設(shè)備復雜;能耗高 | 原料利用率高;廢棄物少 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
在呼吸面具和潛水艇中可用Na2O2作為供氧劑,請選擇適當?shù)幕瘜W試劑和實驗用品,用下圖中的實驗裝置進行試驗,證明Na2O2可作供氧劑。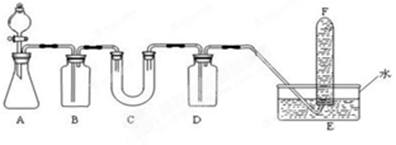
(1)A是制取CO2的裝置。在實驗室里,CO2常用稀鹽酸與石灰石反應來制取,反應的化學方程式為: 。(2分)
(2)填寫表中空格:
| 儀器 | 加入試劑 | 加入該試劑的目的 |
| B | 飽和NaHCO3溶液 | (2分) |
| C | Na2O2 | (2分) |
| D | NaOH溶液 | (2分) |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
綠礬是一種重要的化工原料。
【問題1】綠礬晶體(FeSO4·7H2O)由于保存不妥或長久放置,容易被空氣中的氧氣氧化而變質(zhì)。為探究綠礬樣品的變質(zhì)情況,某化學興趣小組的同學設(shè)計了下列實驗方案。
實驗準備:取少量綠礬樣品,用蒸餾水在燒杯中配成溶液。
(1)方案1:取少量溶液,加入幾滴 試劑(寫化學式),如果觀察到的現(xiàn)象是溶液變血紅色;實驗結(jié)論:證明綠礬樣品已被氧化。
(2)方案2:取少量溶液,加入幾滴酸性KMnO4溶液,如果觀察到的現(xiàn)象是 。實驗結(jié)論:證明綠礬樣品完全被氧化。
(3)使用FeSO4時,如要防止Fe3+的干擾,可以加入適量鐵粉進行除雜,寫出加入鐵粉后發(fā)生反應的離子方程式 。
(4)要從FeSO4溶液中得到綠礬晶體,必須進行的實驗操作步驟: 、冷卻結(jié)晶、 過濾、自然干燥,在這一系列操作中沒有用到的儀器有 (此空填序號)
| A.蒸發(fā)皿 | B.石棉網(wǎng) | C.燒杯 | D.玻璃棒 |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
一定濃度NaHCO3溶液與CuSO4溶液反應后生成了藍綠色顆粒狀沉淀。就沉淀成分提出了如下三種假設(shè):
假設(shè)一:沉淀是CuCO3;假設(shè)二:沉淀是Cu(OH)2;
假設(shè)三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)寫出假設(shè)二,沉淀是Cu(OH)2生成的理由 (用離子方程式表示);
(2)為了探究沉淀的成分,取出了一部分沉淀,滴加稀鹽酸,有氣體放出。憑此現(xiàn)象,判斷沉淀中含有 _;
(3)為了進一步探究沉淀的成分,進而確定假設(shè)中何種假設(shè)成立,設(shè)計實驗,裝置圖如下: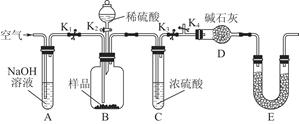
①研究沉淀物組成前,須將沉淀從溶液中分離并凈化。具體操作依次為 _ 、洗滌、干燥;
②裝置E中藥品的名稱是 __作用為 __;
③實驗過程中有以下操作步驟:a.打開K1、K3,關(guān)閉K2、K4,通入過量空氣。此步驟的作用是 ;
b.關(guān)閉K1、K3,打開K2、K4,充分反應,c.再通入過量空氣時,活塞處于打開的是 _,關(guān)閉的是 _。
④若沉淀樣品的質(zhì)量為m g,裝置D的質(zhì)量增加了n g;若沉淀樣品為純凈物,m、 n之間的關(guān)系為 _
若假設(shè)三成立,則Cu(OH)2的質(zhì)量分數(shù)為 _;若不進行步驟c,則會使測得結(jié)果 (填“偏高”“無影響”“偏低”)。
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
為了檢驗市場上常見兩種金屬飲料瓶的主要成分,某小組取甲、乙兩種飲料瓶,將其剪碎作為樣品,分別按下述步驟進行實驗:
I.取少量樣品于試管中,加入鹽酸,充分反應后過濾。
II.取少量濾液于試管中,向其中滴加氫氧化鈉溶液。
步驟II的實驗現(xiàn)象如下:
| 樣品甲 | 生成白色沉淀,繼續(xù)滴加氫氧化鈉溶液,沉淀消失 |
| 樣品乙 | 生成白色沉淀,白色沉淀迅速變?yōu)榛揖G色,最終變?yōu)榧t褐色 |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com