

 WI2(g)。為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL的密閉容器中,加熱使其反應。如圖是WI2(g)的物質的量隨時間變化關系圖象,其中曲線I(0~t2時間段)的反應溫度為T1,曲線II(從t2開始)的反應溫度為T2,且T2>T1。則:①該反應的△H 0(填“大于”
WI2(g)。為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL的密閉容器中,加熱使其反應。如圖是WI2(g)的物質的量隨時間變化關系圖象,其中曲線I(0~t2時間段)的反應溫度為T1,曲線II(從t2開始)的反應溫度為T2,且T2>T1。則:①該反應的△H 0(填“大于”
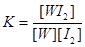
 (1分)
(1分) Cl2↑+H2↑+2OH-(2分)
Cl2↑+H2↑+2OH-(2分)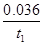 mol·L-1·min-1(1分)③A(1分)
mol·L-1·min-1(1分)③A(1分) 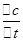 來計算反應速率;
來計算反應速率;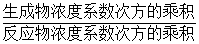 ;
; ,故答案為:
,故答案為: ;
; Cl2↑+H2↑+2OH-,故答案為:2C1-+2H2O
Cl2↑+H2↑+2OH-,故答案為:2C1-+2H2O Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;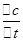 =
=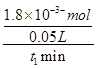 =
=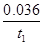 mol?L-1?min-1,故答案為:
mol?L-1?min-1,故答案為: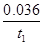 mol?L-1?min-1;
mol?L-1?min-1;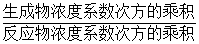 ,但是固體單質W不列入表達式中,故A錯誤;
,但是固體單質W不列入表達式中,故A錯誤;

科目:高中化學 來源:不詳 題型:填空題

 H2(g)+CO2(g),該反應的平衡常數隨溫度的變化如下表:
H2(g)+CO2(g),該反應的平衡常數隨溫度的變化如下表:| 溫度/℃ | 400 | 500 | 830 |
| 平衡常數K | 10 | 9 | 1 |
| 實驗編號 | 反應物投入量 | 平衡時H2濃度 | 吸收或放出的熱量 | 反應物轉化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[來源:] |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol 則N2(g)+3H2(g) 2NH3(g)的△H= ;
則N2(g)+3H2(g) 2NH3(g)的△H= ;查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
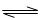 2NO(g),是導致汽車尾氣中含有NO的原因之一。T℃時,向容積為2 L的密閉容器中充入10molN2與5molO2,達到平衡后NO的物質的量為2mol,則T℃時該反應的平衡常數K= 。(計算結果保留小數點后兩位數字)
2NO(g),是導致汽車尾氣中含有NO的原因之一。T℃時,向容積為2 L的密閉容器中充入10molN2與5molO2,達到平衡后NO的物質的量為2mol,則T℃時該反應的平衡常數K= 。(計算結果保留小數點后兩位數字)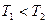 )
)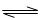 N2(g)+O2(g)為(填“吸熱”或“放熱) 反應。
N2(g)+O2(g)為(填“吸熱”或“放熱) 反應。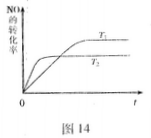
 N2(g)+O2(g)已達到平衡的是(填序號) 。
N2(g)+O2(g)已達到平衡的是(填序號) 。查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
A. | B. | C. | D. |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.在負極上發生氧化反應 |
| B.化學性質較活潑的金屬為負極 |
| C.在外電路上電子由負極流向正極 |
| D.是由電能轉化為化學能的裝置 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com