
【題目】鈦、鉻、鐵、鎳、銅等金屬及其化合物在工業上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至過量,過程中會先有沉淀生成,后沉淀逐漸溶解。
①寫出沉淀溶解過程的離子方程式___________________。
②Cu2+基態時核外電子排布式為____________________。
③金屬銅采取_____堆積。
④NH3分子空間構型為__________________。
(2)制備CrO2Cl2的反應為:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化學方程式中非金屬元素電負性由大到小的順序是_____________(用元素符號表示)。
②COCl2分子中所有原子均滿足8電子構型,COCl2分子中σ鍵和π鍵的個數比為_____,中心原子的雜化方式為____________________。
(3)NiO、FeO的晶體結構均與氯化鈉的晶體結構相似,其中Ni2+和Fe2+的離子半徑分別為6.9×10-2nm和7.8×10-2nm,則熔點:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用廣泛的儲氫材料。具有大容量、高壽命、耐低溫等特點,在日本和中國己實現了產業化。該合金的晶胞結構如下圖所示。

①該晶體的化學式為_______________________。
②已知該晶胞的摩爾質量為Mg/mol,密度為dg·cm-3。設NA為阿伏加德羅常數的值,則該晶胞的體積是_________cm3(用含M、d、NA的代數式表示)。
【答案】 Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O 1s22s22p63s23p63d9或[Ar]3d9 面心立方最密堆積 三角錐形 O>Cl>C 3:1 sp2 > LaNi5 M/NAd
【解析】本題考查物質結構與性質。
解析:(1)①向CuSO4溶液中逐滴滴加氨水時,先生成藍色的氫氧化銅沉淀,繼續滴加氨水,藍色的氫氧化銅沉淀與氨水反應,生成深藍色溶液的銅氨絡離子,反應的離子方程式為:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O;②Cu原子核外電子排布為1s22s22p63s23p63d104s1,4s與3d能級各失去1個電子形成Cu2+,則Cu2+基態核外電子排布式為1s22s22p63s23p63d9;③金屬Cu采取面心立方堆積;④NH3分子中N原子的價層電子對數為4,孤對電子對數為1,則空間構型為三角錐形。(2)①反應中有O、C、Cl三種非金屬元素參與反應,元素的非金屬性越強,電負性越大,非金屬性強弱順序為O>Cl>C,由大到小的順序是O>Cl>C;②由題意可知,COCl2分子中含有1個C、O雙鍵和2個C、Cl單鍵,單鍵都是σ鍵,雙鍵中1個為σ鍵和1個π鍵,則COCl2分子中σ鍵和π鍵的個數比為3∶1;因分子中含有C、O雙鍵,所以C原子為sp2雜化。(3)Ni0、Fe0的晶體結構類型均與氯化鈉的相同,說明二者都是離子晶體,離子晶體的熔點與離子鍵的強弱有關,離子所帶電荷數越多,離子半徑越小,離子鍵越強,熔點越高.由于Ni2+的離子半徑小于Fe2+的離子半徑,屬于熔點是NiO>FeO。(4)①從圖中可以看出,La位于平行六面體的頂點,晶胞中La的原子數為8×![]() =1,平行六面體的上、下兩個面各有2個Ni原子,四個側面各有1個Ni原子,體心還有1個Ni原子,晶胞中Ni的原子數為8×
=1,平行六面體的上、下兩個面各有2個Ni原子,四個側面各有1個Ni原子,體心還有1個Ni原子,晶胞中Ni的原子數為8×![]() +1=5,則該晶體的化學式為LaNi5;②晶胞中含有1個LaNi5,晶胞的質量為
+1=5,則該晶體的化學式為LaNi5;②晶胞中含有1個LaNi5,晶胞的質量為![]() ×M, 根據m=dV,晶胞的體積為
×M, 根據m=dV,晶胞的體積為![]() cm3。點晴:本題難點是晶胞結構的分析與與有關計算。使用均攤法計算晶胞微粒個數時,應意晶胞的形狀,不同形狀的晶胞應先分析任意位置上的一個微粒被幾個晶胞所共有,如六棱柱晶胞中頂點、側棱點、底面棱點和面心點依次被6、3、4、2不晶胞所共有。
cm3。點晴:本題難點是晶胞結構的分析與與有關計算。使用均攤法計算晶胞微粒個數時,應意晶胞的形狀,不同形狀的晶胞應先分析任意位置上的一個微粒被幾個晶胞所共有,如六棱柱晶胞中頂點、側棱點、底面棱點和面心點依次被6、3、4、2不晶胞所共有。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】(1)請寫出以下物質的電子式:Na2O2__________H2S___________
(2)用“>”或“<”回答下列問題:
酸性:H2SiO3____H3PO4;穩定性:HCl____CH4;氧化性:Cu2+_____Fe3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)氯堿廠電解飽和食鹽水制取NaOH的工藝流程示意圖如下
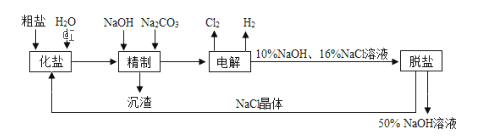
(1)粗鹽中含CaCl2、MgCl2等雜質,寫出精制過程中發生反應的離子方程式是________,________.
(2)如果粗鹽中SO42﹣含量較高,必須添加鋇式劑除去SO42﹣ ,該鋇試劑可以是____
A.Ba(OH)2B.Ba(NO3)2C.BaCl2
(3)電解過程中所發生反應的化學方程式為________,與電源正極相連的電極附近產生的氣體是________,檢驗該氣體可使用的試紙及現象是.
(4)氯堿工廠生產的氯氣和氫氣可以進一步用于生產鹽酸,主要過程如下:
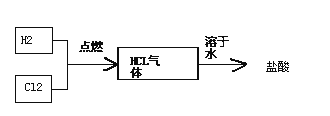
其中關鍵的一步為氯氣和氫氣在燃燒管口燃燒生成HCl,氯氣有毒,應采取的措施是________.合成鹽酸廠要求合成氣中的HCl的含量要大于97%,試用最簡便的方法進行分析是否含量大于97%________.
(5)氯堿工廠生產的氯氣和氫氧化鈉溶液可以用于制取“84消毒液”,反應的化學方程式為________.
(6)某同學欲證明鹽酸與氯化氫氣體性質不同,他分別向A、B、C三支潔凈試管中各放入一片干燥的藍色石蕊試紙,然后往A試管內加入鹽酸,試紙顯________色,往B試管中通入干燥的氯化氫氣體,試紙顯________色.最后向C試管中加入物質________(填化學式),他之所以加入這種物質的理由是________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是( )
A. ![]() =1×10-13 mol·L-1的溶液中:NH
=1×10-13 mol·L-1的溶液中:NH![]() 、Ca2+、Cl-、NO
、Ca2+、Cl-、NO![]()
B. 使酚酞變紅色的溶液中:Na+、Al3+、SO![]() 、Cl-
、Cl-
C. 與Al反應能放出H2的溶液中:Fe2+、K+、NO![]() 、SO
、SO![]()
D. 水電離的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO![]() 、CO
、CO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,其中甲池的總反應式為2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列說法正確的是
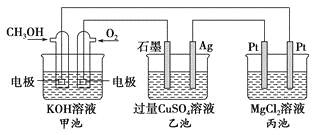
A. 甲池是電能轉化為化學能的裝置,乙、丙池是化學能轉化電能的裝置
B. 甲池通入CH3OH的電極反應式為CH3OH-6e-+2H2O===CO32-+8H+
C. 反應一段時間后,向乙池中加入一定量Cu(OH)2固體能使CuSO4溶液恢復到原濃度
D. 甲池中消耗280 mL(標準狀況下)O2,此時丙池中理論上最多產生1.45 g固體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 乙醇的沸點高于丙烷
B. 氨基酸既能與鹽酸反應,也能與NaOH反應
C. 甘油、汽油、植物油不屬于同一類有機物
D. 光照時異戊烷發生取代反應生成的一氯代物最多有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于硝酸的敘述正確的是( )
A. NO2溶于水生成硝酸,所以NO2是酸性氧化物
B. 硝酸可與活潑金屬反應生成鹽和氫氣
C. 常溫下鐵與濃硝酸反應,產生大量的紅棕色氣體
D. 硝酸與銅的反應既表現出氧化性又表現出酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C5H12有3種不同結構:甲[CH3(CH2)3CH3]、乙[CH3CH(CH3)CH2CH3]和丙[C(CH3)4],下列相關敘述正確的是
A. 甲、乙、丙屬于同系物,均可與氯氣、溴蒸氣發生取代反應
B. 甲、乙、內都屬于烷烴
C. C6H12表示一種純凈物
D. 乙有3種不同沸點的一氯代物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒(Se)被譽為“生命的奇效元素”。富硒食品倍受追捧。已知硒元素與氧元素同族。與鈣元素同周期。下列關于硒的描述錯誤的是
A. 原子序數是24
B. 原子半徑比硫原子的原子半徑大
C. 最高價氧化物是SeO3,是酸性氧化物
D. 氣態氫化物化學式是H2Se,還原性比HCl強
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com