
440℃時2SO2(g) + O2(g) 2SO3(g) △H=-198kJ/mol,在甲、乙、丙三個容積均為2 L的恒容密閉容器中投入SO2(g)和O2(g),經5min達到平衡。其起始物質的量及SO2的平衡轉化率如下表所示。
2SO3(g) △H=-198kJ/mol,在甲、乙、丙三個容積均為2 L的恒容密閉容器中投入SO2(g)和O2(g),經5min達到平衡。其起始物質的量及SO2的平衡轉化率如下表所示。
| | 甲 | 乙 | 丙 | |
| 起始物質的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
| n(O2) / mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡轉化率 | 80% | α1 | α2 | |
C
解析試題分析:A、平衡時消耗SO2的物質的量是0.4mol×0.8=0.32mol,濃度是0.32mol÷2L=0.16mol/L,因此甲中SO2的速率為0.16mol/L÷5min=0.032mol·L-1·min-1,A不正確;B、平衡時SO2的濃度是0.08mol/L÷2L=0.04mol/L,三氧化硫的濃度是0.16mol/L,氧氣的濃度是(0.24mol-0.16mol)÷2L=0.04mol/L,所以該溫度下反應的平衡常數K= =400,B正確;C、正方應是放熱反應,升高溫度平衡向逆反應方向移動,平衡常數減小,C不正確;D、乙容器相當于是在甲容器的基礎上增大二氧化硫的濃度,二氧化硫的轉化率降低;丙容器相當于是在甲容器的基礎上增大壓強,平衡向正反應方向移動,二氧化硫的轉化率增大,D正確,答案選C。
=400,B正確;C、正方應是放熱反應,升高溫度平衡向逆反應方向移動,平衡常數減小,C不正確;D、乙容器相當于是在甲容器的基礎上增大二氧化硫的濃度,二氧化硫的轉化率降低;丙容器相當于是在甲容器的基礎上增大壓強,平衡向正反應方向移動,二氧化硫的轉化率增大,D正確,答案選C。
考點:考查可逆反應的有關計算以及外界條件對平衡狀態的影響


科目:高中化學 來源: 題型:單選題
在密閉容器中發生反應: aX(g)+bY(g) 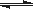 cZ(g)+dW(g)反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,W的濃度為原平衡狀態的1.8倍。下列敘述正確的是( )
cZ(g)+dW(g)反應達到平衡后,將氣體體積壓縮到原來的一半,當再次達到平衡時,W的濃度為原平衡狀態的1.8倍。下列敘述正確的是( )
| A.平衡向正反應方向移動 | B.(a+b)>(c+d) |
| C.Z的體積分數變大 | D.X的轉化率變小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
25℃時,在含有Pb2+、Sn2+的某溶液中,加入過量金屬錫(Sn),發生反應:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),體系中c(Pb2+)和c(Sn2+)變化關系如下圖所示。下列判斷正確的是
Sn2+(aq)+Pb(s),體系中c(Pb2+)和c(Sn2+)變化關系如下圖所示。下列判斷正確的是
| A.往平衡體系中加入金屬鉛后,c(Pb2+)增大 |
| B.往平衡體系中加入少量Sn(NO3)2固體后,c(Pb2+)變小 |
| C.升高溫度,平衡體系中c(Pb2+)增大,說明該反應⊿H>0 |
| D.25℃時,該反應的平衡常數K=2.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
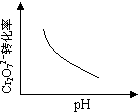
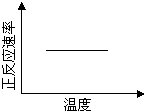
電鍍廢液中Cr2O72-可通過下列反應轉化成鉻黃(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+ H2O(l) 2PbCrO4(s)+2H+(aq)△H<0
2PbCrO4(s)+2H+(aq)△H<0
該反應達平衡后,改變橫坐標表示的反應條件,下列示意圖正確的是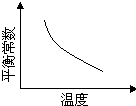
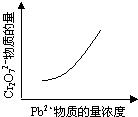
A B C D
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4與N2在不同物質的量之比[n(CH4)/n(N2)]時CH4的平衡轉化率如下圖所示:
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4與N2在不同物質的量之比[n(CH4)/n(N2)]時CH4的平衡轉化率如下圖所示: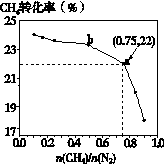
下列說法正確的是
| A.n(CH4)/n(N2)越大,CH4的轉化率越高 |
| B.n(CH4)/n(N2)不變時,若升溫,NH3的體積分數會增大 |
| C.b點對應的平衡常數比a點的大 |
| D.a點對應的NH3的體積分數約為26% |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定溫度下,對于反應N2+O2 2NO在密閉容器中進行,下列措施能增大反應速率的是 ( )。
2NO在密閉容器中進行,下列措施能增大反應速率的是 ( )。
| A.降低溫度 | B.恒容充入氮氣 | C.恒壓充入氦氣 | D.恒容充入氦氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
常溫下,將Cl2緩慢通入水中至飽和,然后向所得飽和氯水中滴加0.1mol·L—1的NaOH溶液。整個實驗進程中溶液的pH變化曲線如圖所示,下列敘述正確的是
| A.實驗進程中可用pH試紙測定溶液的pH |
B.c點所示溶液中: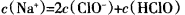 |
| C.向a點所示溶液中通入SO2,溶液的酸性和漂白性均增強 |
D.由a點到b點的過程中,溶液中 減小 減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
可逆反應A(?)+a B(g)? ?C(g)+2 D(g)(a為正整數)。反應過程中,當其他條件不變時,C的百分含量(C%)與溫度(T)和壓強(p)的關系如圖所示。下列說法不正確的是
?C(g)+2 D(g)(a為正整數)。反應過程中,當其他條件不變時,C的百分含量(C%)與溫度(T)和壓強(p)的關系如圖所示。下列說法不正確的是 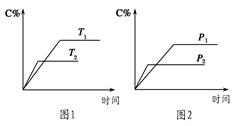
| A.當壓強由p1變為 p2時,逆反應速率將變大 |
| B.該反應的正反應為放熱反應 |
| C.若a=2,則A為液態或固體 |
| D.恒溫恒容條件下,增加B的物質的量,B的轉化率和該反應的化學平衡常數都將增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列說法正確的是
A.已知2SO2(g)+ O2(g) 2SO3 (g)△H<0,該反應在任何溫度下均可自發進行 2SO3 (g)△H<0,該反應在任何溫度下均可自發進行 |
| B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3) |
| C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) ="l.0" × l0-a,該溶液的pH=7+0.5a |
| D.室溫下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向濃度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1AgNO3溶液,先生成Ag2CrO4沉淀 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com